A obesidade é um problema de saúde pública, com uma prevalência crescente em todo o mundo. De acordo com a Organização Mundial da Saúde (OMS), o índice de obesidade mais do que triplicou desde 1975. Estima-se que, em 2016, mais de 1,9 bilhão de adultos estavam com excesso de peso, dos quais mais de 650 milhões eram clinicamente obesos. Trata-se de um grave problema, com múltiplas repercussões, que atinge todas as faixas etárias e grupos socioeconômicos e geográficos.
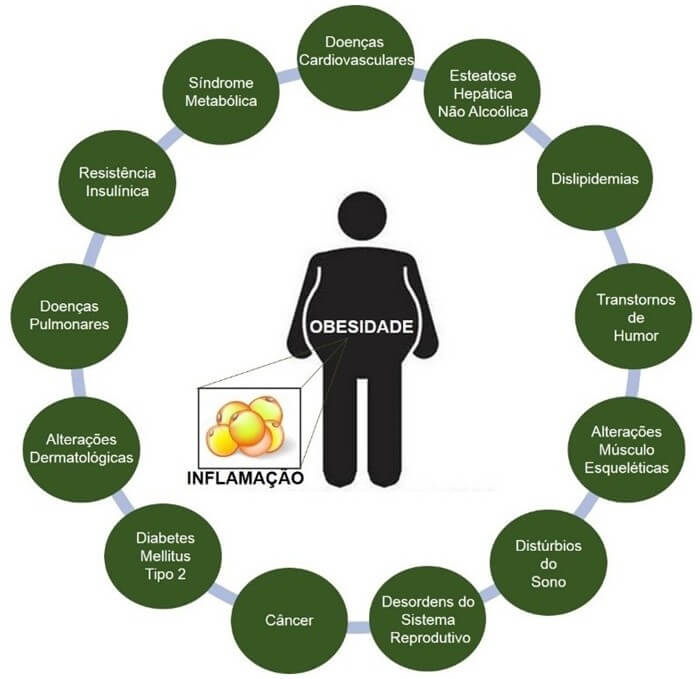
Muitos acreditam que a obesidade é apenas uma questão estética, o que não é verdade. É uma patologia que cursa com uma série de complicações médicas, como diabetes do tipo 2, doenças cardiovasculares, hipertensão, distúrbios articulares e certos tipos de câncer e que causa impactos significativos na qualidade de vida (Figura 1).
Além disso, o custo para manejar o tratamento e as complicações relacionadas com a obesidade é extremamente elevado, onerando muito o sistema de saúde, tanto no setor público quanto no privado.
Os métodos tradicionais de tratamento, como mudanças na dieta e no estilo de vida, embora fundamentais, muitas vezes não são suficientes para conter o avanço da epidemia global de obesidade. Nesse contexto, validar novas abordagens terapêuticas torna-se imprescindível, através de pesquisas e busca de novos caminhos para o tratamento da obesidade e suas complicações.
Sendo assim, este artigo tem por objetivo correlacionar, de forma concisa, o sistema endocanabinoide, a cannabis medicinal e a obesidade sob uma nova perspectiva.
O sistema endocanabinoide não pode ser ignorado quando falamos de medicina integrativa. E modular esse sistema é fundamental para a homeostase do organismo, sendo o uso de fitocanabinoides uma terapêutica inovadora e promissora.
Sistema endocanabinoide e regulação metabólica
O sistema endocanabinoide é um sistema de modulação lipídica que consiste em uma rede complexa de sinalização bioquímica, desempenhando um papel fundamental na regulação do apetite e do metabolismo e no armazenamento de energia.
Consiste em receptores canabinoides, endocanabinoides endógenos, como anandamida (AEA) e 2-araquidonilglicerol (2AG) e enzimas responsáveis pela síntese e degradação desses compostos. As enzimas de degradação mais conhecidas do sistema endocanabinoide são a amida hidrolase de ácidos graxos (FAAH) e a lipase de monoacilglicerol (MAGL), que degradam respectivamente a AEA e o 2AG.
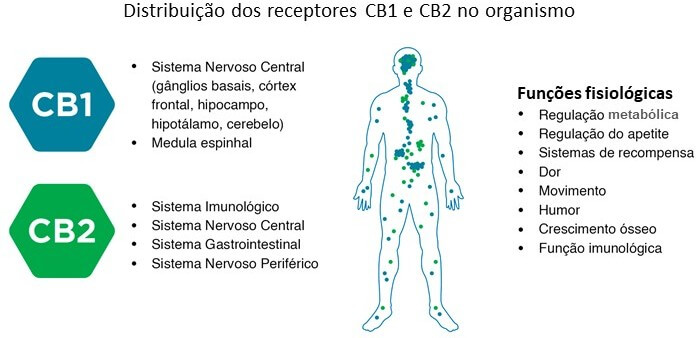
Os receptores canabinoides, principalmente os subtipos CB1 e CB2, estão amplamente distribuídos no sistema nervoso central, em tecidos periféricos e em órgãos relacionados ao metabolismo, como o fígado, músculos e tecido adiposo (Figura 2). A ativação desses receptores desempenha um papel crucial na regulação do apetite e do metabolismo energético e na homeostase geral do organismo.
O sistema endocanabinoide também influencia na termogênese, no gasto energético e na função mitocondrial, todos elementos-chave na regulação do metabolismo e na manutenção do equilíbrio energético do organismo.
Estudos demonstram que o sistema endocanabinoide, por meio do receptor CB1 principalmente, regula a ingestão alimentar, afetando tanto a fome quanto a saciedade. Além disso, está envolvido no metabolismo de lipídios e glicose, no controle do peso corporal e no armazenamento de energia. A ativação do receptor CB1 tende a aumentar o apetite e promover o armazenamento de gordura, enquanto sua inibição tem sido associada à redução do apetite, diminuição do peso corporal e melhora da gordura visceral e da esteatose hepática.
Impacto da dieta ocidental na disfunção do sistema endocanabinoide: perspectivas e evidências
O sistema endocanabinoide é um sistema de modulação lipídica, composto por receptores, endocanabinoides e enzimas de degradação relacionadas, e desempenha um papel fundamental na regulação do apetite, no metabolismo energético e no armazenamento de gordura. Pesquisas indicam que o consumo em excesso de gorduras saturadas e açúcares refinados pode alterar a produção e a ação dos endocanabinoides, levando a desequilíbrios no sistema endocanabinoide.
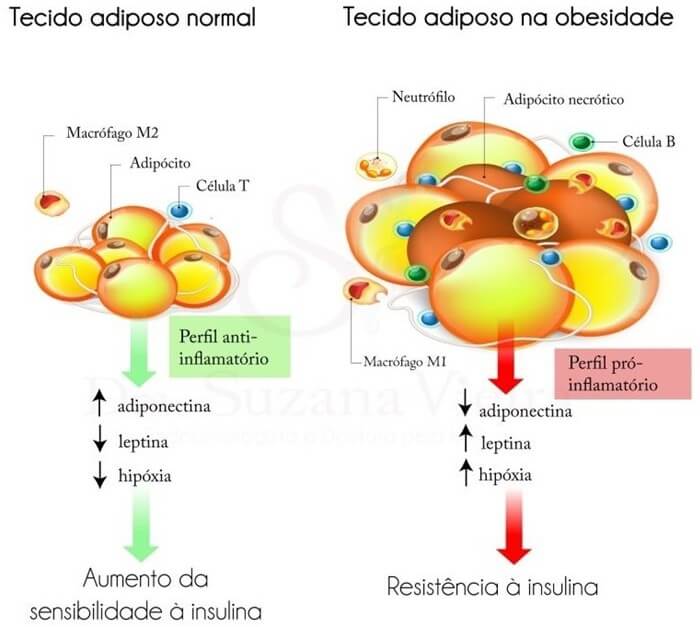
A dieta ocidental é reconhecida por seu papel obesogênico e inflamatório, influenciando no funcionamento do sistema endocanabinoide no corpo humano (Figura 3). Esse padrão alimentar, caracterizado por alto teor de gorduras saturadas, açúcares refinados e alimentos processados e ultraprocessados, tem sido associado a desequilíbrios metabólicos e inflamação, afetando direta e indiretamente o sistema endocanabinoide.
Estudos têm demonstrado que a dieta ocidental desencadeia respostas inflamatórias no organismo. O consumo excessivo de gorduras saturadas e açúcares refinados tem sido associado à ativação crônica do sistema imunológico, levando a um estado inflamatório persistente. Essa inflamação crônica interfere na regulação metabólica e está ligada a distúrbios como resistência à insulina, obesidade e outras condições crônicas.
Pesquisadores sugerem que a dieta rica em gorduras saturadas e açúcares pode interferir na sinalização endocanabinoide, contribuindo para mudanças no apetite, metabolismo energético e armazenamento de gordura e em respostas desreguladas aos estímulos alimentares.
Entender como a dieta ocidental afeta o sistema endocanabinoide é crucial para abordar as epidemias de obesidade e distúrbios metabólicos associados. Estratégias que promovam a mudança para uma dieta mais equilibrada, rica em nutrientes e pobre em alimentos processados, com uma boa proporção de ômegas 3 e 6, são fundamentais para regular o sistema endocanabinoide e prevenir complicações metabólicas.
Outras recomendações da OMS para uma dieta equilibrada são consumir mais peixes marinhos, como sardinha, salmão selvagem, atum, arenque e cavala, no mínimo por três vezes na semana, inserir linhaça no dia a dia, reduzir o consumo de óleo vegetal e de frituras e aumentar o consumo de verduras e legumes.
Papel da cannabis medicinal e seus canabinoides na modulação do sistema endocanabinoide
A cannabis medicinal, com sua rica composição de canabinoides, terpenos e flavonoides, tem sido objeto de estudo devido à sua interação com o sistema endocanabinoide, desempenhando um papel significativo na modulação dos receptores canabinoides e na regulação desse sistema.
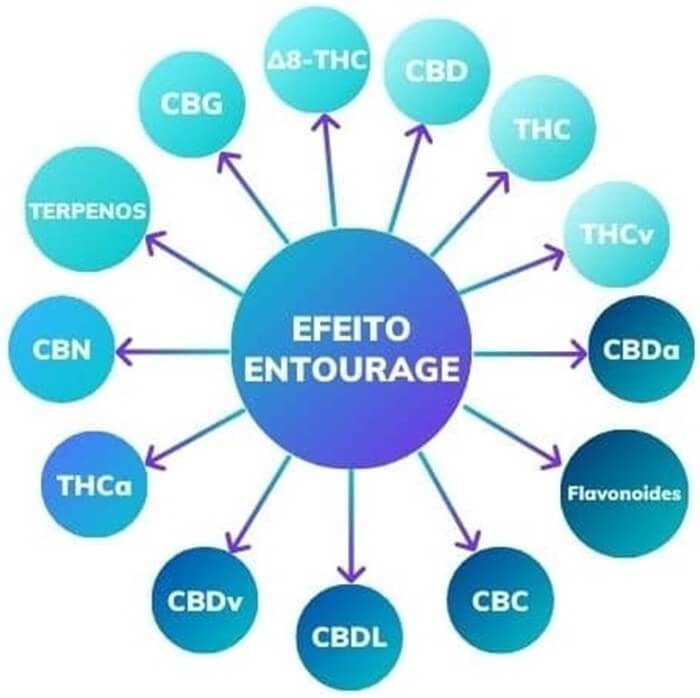
A composição peculiar da planta foi muito estudada e os pesquisadores notaram que, quando era usado o extrato da planta toda (full spectrum), obtinham-se efeitos melhores utilizando doses menores. Foi aí determinada uma característica da cannabis chamada “efeito entourage” ou “efeito comitiva”, em que se observa o efeito sinérgico de todos os componentes: fitocanabinoides, canaflavinas e terpenos, além da clorofila (Figura 4).
Os terpenos e flavonoides presentes na planta também atuam indiretamente no sistema endocanabinoide expandido, com inúmeros benefícios para a saúde.
Os principais canabinoides encontrados na cannabis, como o tetrahidrocanabinol (THC) e o canabidiol (CBD), interagem de maneira distinta com os receptores canabinoides, determinando a sinalização do sistema endocanabinoide.
O THC, um dos principais constituintes da cannabis, tem afinidade considerável com o receptor CB1, promovendo a ativação desse receptor, com consequente efeito euforizante e aumento de apetite. O THC atua ainda na regulação de neurotransmissores e de processos fisiológicos ligados à fome e ao metabolismo.
Por outro lado, o canabidiol (CBD) demonstra um perfil de interação mais complexo. Embora não se ligue diretamente aos receptores canabinoides, o CBD pode modular os efeitos do THC no CB1, atenuando alguns desses efeitos, incluindo os associados ao apetite.
Principais canabinoides presentes na cannabis
São muitos os canabinoides presentes na cannabis e seria impossível descrever todos em um único texto. Então, a seguir serão destacados os principais (Figura 5).
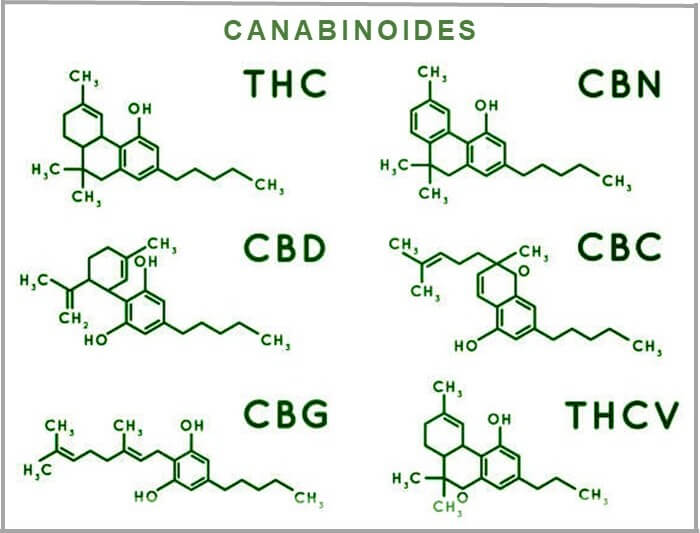
Tetrahidrocanabinol (THC)
O tetrahidrocanabinol (THC) ou delta(9)-tetrahidrocanabinol (Δ9-THC) é, provavelmente, o canabinoide mais famoso. É o responsável pelo efeito euforizante (erroneamente chamado de “efeito psicoativo”) da cannabis e liga-se principalmente aos receptores encontrados no cérebro.
É capaz de reduzir ou, até mesmo, eliminar dores, náuseas e o estresse, além de estimular o apetite e combater a insônia. Alguns de seus efeitos já foram comprovados em estudos clínicos e, atualmente, fármacos com sua presença são aplicados como analgésicos (principalmente no caso de dor crônica e neuropática), no controle de espasmos causados pela esclerose múltipla e como antiemético (no tratamento de enjoo causado por quimioterapia).
Outros possíveis benefícios ainda são alvos de pesquisas. Sugere-se que o THC funcione como um neuroprotetor, podendo ser eficiente contra epilepsia e outras doenças degenerativas, como Alzheimer e Parkinson. Além disso, como anti-inflamatório, poderia ser útil no tratamento de doenças como artrite reumatoide e, como antitumoral, na inibição do crescimento de células cancerígenas.
Canabidiol (CBD)
Também bastante conhecido, ocanabidiol (CBD) é, atualmente, o canabinoide mais bem aceito para uso medicinal em todo o mundo. Não possui efeitos euforizantes e representa quase 40% dos extratos da planta. Sua eficiência já foi estudada e os resultados são positivos no tratamento de epilepsia, ansiedade e até doença de Alzheimer.
Ao entrar no organismo humano, o CBD conecta-se a neurotransmissores, como os de adenosina e serotonina. Essa interação resulta em efeitos positivos relacionados à ansiedade, inflamação, cognição, controle motor, percepção da dor, náusea e apetite.
Canabinol (CBN)
Trata-se de um canabinoide com efeito modulador de receptores e neurotransmissores, que surge da degradação do THC. Ou seja, quanto mais a cannabis é envelhecida, maior é a concentração de CBN. Há pouquíssimo canabinol na planta in natura.
Ele potencializa os efeitos do THC, causando no corpo humano sensação de torpor e desejo de ficar prostrado, além de leve sedação. Acredita-se que o CBN possa ser útil no tratamento de dores crônicas e glaucoma, bem como no estímulo ao apetite, mas ainda não existem estudos conclusivos.
Canabigerol (CBG)
Esse canabinoide ainda é pouco estudado, mas há um volume crescente de pesquisas em andamento, como mostra o relatório Cannabis – Pesquisa, Inovação e Tendências de Mercado da The Green Hub.
Os dados existentes sobre o CBG apontam efeitos anticancerígenos, anti-inflamatórios, analgésicos e bactericidas. Há ainda a possibilidade de aplicação no tratamento de epilepsia e glaucoma, já que parece ter impacto na redução da pressão intraocular e no aumento de apetite.
O CBG é um canabinoide não euforizante e abundante em plantas com baixo teor de THC. Assim como o THC, reage com os receptores canabinoides do cérebro, mas com efeitos diferentes. É possível ainda que ele amenize os efeitos euforizantes do THC. Inúmeras pesquisas apontam que ele tem ação em melhorar dores crônicas e foco.
Ácido tetrahidrocanabinol (THCA)
O THCA ou ácido tetra-hidrocanabinólico é o THC em sua forma ácida e existe, majoritariamente, na planta in natura. À medida que a planta seca após ser colhida, o THCA converte-se lentamente em THC. O calor acelera essa conversão, através do processo químico conhecido como descarboxilação, que retira o grupo carboxila (COOH) extra em sua composição. Diferente do THC, o THCA não tem efeito euforizante.
Há poucas pesquisas sobre ele, mas elas buscam confirmar efeitos imunomoduladores, podendo estimular ou reprimir respostas imunológicas do corpo humano. Isso pode ser útil em doenças que atacam o sistema imunológico, como a AIDS, e em doenças autoimunes, incluindo esclerose múltipla e doença de Chron.
Tetrahidrocanabivarina (THCV)
O THCV (tetrahidrocanabivarina) é semelhante ao THC em sua estrutura molecular e nas propriedades euforizantes, mas causa efeitos completamente diferentes. Ao contrário do THC, que causa fome, esse composto pode diminuir o apetite.
Por esse efeito inibidor da fome, o THCV despertou recentemente o interesse da empresa britânica GW Pharmaceuticals, que estuda a possibilidade de criar um medicamento com esse canabinoide para tratar a obesidade. Entretanto, já existem produtos no mercado que disponibilizam o THCV tanto na forma nanossolúvel (aquosa) quanto na versão oleosa.
Algumas pesquisas também sugerem a eficiência do THCV para controlar níveis de açúcar no sangue e reduzir a resistência à insulina, além de atuar nas células ósseas, ajudando no crescimento. Esse canabinoide tem ainda a capacidade de potencializar os efeitos medicinais do THC.
Canabicromeno (CBC)
Apesar de menos famoso, em relação ao CBD e THC, o canabicromeno (CBC) é de extrema importância. Ele age ativando receptores do organismo e pode aumentar os níveis dos endocanabinoides naturais do corpo, como por exemplo a anandamida – conhecida como a substância da felicidade.
Embora o composto tenha seus próprios benefícios, os pesquisadores também acreditam que ele pode trabalhar com outros canabinoides, em um processo conhecido como efeito entourage, quando dois ou mais elementos se unem e potencializam ou mudam o efeito um do outro. Isolado, ele pode ajudar no combate ao câncer, dores, inflamações, depressão e até acne.
Discussão sobre a ação do sistema endocanabinoide na regulação do peso corporal e metabolismo: influência dos receptores canabinoides
Estudos científicos demonstraram uma correlação íntima entre o sistema endocanabinoide e a regulação do peso corporal, apetite e metabolismo. Os receptores canabinoides, CB1 e CB2, desempenham um papel significativo nessa regulação e são amplamente distribuídos no sistema nervoso central e periférico, bem como em órgãos associados ao metabolismo.
O receptor CB1, em particular, tem sido objeto de estudo extensivo devido ao seu impacto na homeostase do organismo. A ativação do CB1 está associada ao aumento do apetite e à modulação do metabolismo, influenciando a ingestão alimentar e o balanço energético. Pesquisas apontam que o bloqueio seletivo dos receptores CB1 pode resultar na supressão do apetite e na redução do peso corporal.
Além disso, o sistema endocanabinoide, por meio dos receptores canabinoides, desempenha um papel crucial no metabolismo de lipídios e glicose. Evidências indicam sua participação na regulação da gliconeogênese, lipogênese e lipólise, influenciando diretamente o armazenamento de gordura e o consumo de energia.
Estudos clínicos e pré-clínicos apontam que alterações no sistema endocanabinoide podem estar associadas a distúrbios metabólicos, como obesidade, resistência à insulina e dislipidemia. Essas descobertas sustentam a importância do sistema endocanabinoide na regulação do peso corporal e do metabolismo, destacando seus receptores como alvos potenciais para intervenções terapêuticas.
Embora a compreensão desses mecanismos tenha progredido, ainda há questões em aberto. Por exemplo: as pesquisas estão explorando a complexidade das interações entre os receptores canabinoides, a dieta e outros fatores ambientais na regulação do peso corporal. Além disso, estudos detalhados são necessários para entender completamente os efeitos específicos da ativação seletiva ou inibição dos receptores canabinoides na regulação do apetite e do metabolismo.
Essa discussão aprofundada sobre os estudos que ligam o sistema endocanabinoide à regulação do peso corporal enfatiza a importância dos receptores canabinoides na fisiologia do metabolismo e do apetite, sugerindo seu potencial como alvos terapêuticos para condições relacionadas à regulação do peso corporal.
Além do apetite, a cannabis medicinal também mostrou impacto no metabolismo e no armazenamento de gordura. Pesquisas iniciais sugerem que os canabinoides podem influenciar o metabolismo dos lipídios, a lipogênese e a lipólise, processos envolvidos no armazenamento e na quebra de gordura no corpo. Esses efeitos são complexos e multifacetados e sua compreensão completa ainda está em progresso.
Enquanto alguns estudos indicam que o uso crônico de cannabis pode estar associado a um índice de massa corporal (IMC) mais baixo, outros pesquisadores contestam essa correlação direta, sugerindo que fatores individuais, como estilo de vida e genética, podem influenciar os resultados.
Em conclusão, pode-se afirmar que embora haja evidências sugerindo a influência da cannabis no apetite, metabolismo e armazenamento de gordura, a complexidade dos efeitos de seus compostos na regulação fisiológica do corpo humano demanda mais pesquisas para se estabelecer uma compreensão abrangente e definitiva.
Sobre o rimonabanto: “a pílula mágica do emagrecimento”
O rimonabanto é um antagonista do receptor CB1, que foi inicialmente desenvolvido como um medicamento para o tratamento de obesidade e de condições associadas, como a síndrome metabólica. Ele exerce sua ação bloqueando seletivamente os receptores CB1 no sistema endocanabinoide, que estão envolvidos na regulação do apetite e do metabolismo.
Lançado em 2006 no Brasil, foi apresentado pela empresa fabricante como um medicamento que faria o controle do peso corporal, mostrando-se eficaz na redução do peso e atuando através do controle do apetite e do metabolismo, o que era promissor para pacientes obesos ou com sobrepeso. O medicamento também apresentou melhora dos fatores de risco cardiovascular, além da perda de peso, com redução da gordura corporal e visceral, da resistência insulínica e da esteatose hepática.
No entanto, o rimonabanto foi associado a vários efeitos colaterais significativos, incluindo problemas psiquiátricos adversos, como depressão, ansiedade, ideação suicida e distúrbios comportamentais, o que levou à descontinuação de seu uso no Brasil e no mundo, dois anos após o seu lançamento. Além disso, foram observadas outras complicações, como náuseas, vômitos, distúrbios do sono e irritabilidade.
O rimonabanto foi retirado do mercado em vários países, inclusive da União Europeia, principalmente devido aos riscos psiquiátricos associados ao seu uso. Esses efeitos adversos graves, especialmente os relacionados à saúde mental, levaram à preocupação sobre a segurança do medicamento e provavelmente estão relacionados ao antagonismo do receptor CB1 e consequente diminuição da produção de anandamida (AEA) pelo sistema endocanabinoide.
A preocupação com a saúde mental dos pacientes levou à descontinuação do rimonabanto, apesar de sua eficácia no controle de peso e na melhoria dos fatores de risco cardiovascular. Desde então, a pesquisa tem sido direcionada para desenvolver terapias que atuem de maneira eficiente no controle do peso corporal e dos fatores metabólicos, sem os efeitos colaterais adversos observados com o rimonabanto.
Estudos clínicos, como os conduzidos por pesquisadores renomados, como o Professor Joseph Tam, de Israel, demonstraram a eficácia do rimonabanto na redução do peso corporal em pacientes com sobrepeso e obesidade, devido ao seu efeito no controle do apetite e na melhora do perfil metabólico, além dos benefícios já citados anteriormente.
Embora a pesquisa inicial tenha oferecido insights valiosos sobre o potencial terapêutico do rimonabanto, as preocupações com a saúde mental dos pacientes levaram a uma reavaliação de sua viabilidade clínica e a uma reformulação de sua composição.
O Prof. Joseph Tam (Yossi Tam) e seus colaboradores conseguiram estabilizar uma nova forma de rimonabanto em nanopartículas, fazendo com que os efeitos colaterais fossem minimizados por ter ação apenas na gordura visceral, esteatose hepática e metabolismo, porém sem atravessar a barreira hematoencefálica, consolidando-se como uma terapêutica possível no combate à obesidade e às doenças metabólicas, já com estudos clínicos avançados.
Papel do inflamassoma na gênese de doenças
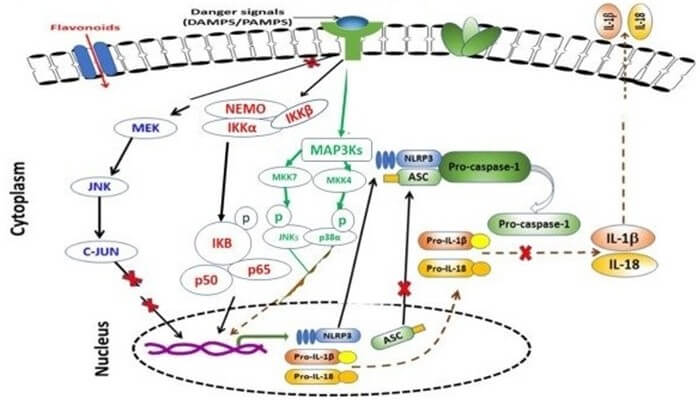
O inflamassoma é um complexo multiproteico intracelular que atua na ativação de enzimas da família cisteína-aspartato proteases (CASPASES), como uma estrutura essencial para a regulação da imunidade em condições fisiológicas e no reconhecimento de sinais de perigo a diferentes componentes. Esses sinais podem ser produtos microbianos, adjuvantes ou alterações no ambiente iônico intra e extracelular.
A participação do inflamassoma está confirmada na patogênese de várias doenças inflamatórias, cuja atuação é moldada pelo tipo de ativação e influenciada pelo microambiente, criando um perfil patogênico diferente para cada doença (Figura 6).
O inflamassoma estabelece um envolvimento estreito com inflamação patológica, pela ativação de vias intracelulares de morte por apoptose, piroptose e necrose, sendo um alvo potencial para o desenvolvimento de estratégias terapêuticas para doenças de base inflamatória. Esta revisão aborda a importância do inflamassoma na patogênese de algumas doenças inflamatórias, como choque séptico, artrite reumatoide, dor neuropática crônica, gota e epilepsia.
Sua ativação está associada a uma série de condições patológicas, incluindo obesidade e outras doenças crônicas. Estudos recentes têm destacado a influência do inflamassoma no desenvolvimento e progressão dessas condições.
Pesquisas, como o estudo realizado por Strowig et al. e publicado na Nature Medicine (2012), evidenciam a conexão entre a ativação do inflamassoma e a obesidade. O tecido adiposo de indivíduos obesos frequentemente exibe sinais de inflamação crônica e a ativação do inflamassoma nessas células adiposas é considerada como um dos mecanismos subjacentes a esse processo inflamatório.
Além disso, a relação entre o inflamassoma e doenças metabólicas, como diabetes do tipo 2, foi explorada em estudos como o de Vandanmagsar et al., publicado na Nature Medicine (2011). Os resultados indicam que a ativação crônica do inflamassoma pode levar a disfunções metabólicas, contribuindo para a resistência à insulina e desregulações no metabolismo da glicose.
O inflamassoma também tem sido associado a outras doenças, como aterosclerose e doenças neurodegenerativas. Estudos, como o de Ridker et al., publicado na New England Journal of Medicine (2017), investigaram a relação entre a ativação do inflamassoma e a ocorrência de eventos cardiovasculares, mostrando que a inflamação sistêmica desempenha um papel significativo no desenvolvimento de condições cardiovasculares.
Adicionalmente, a relação do inflamassoma com doenças neurodegenerativas, como Alzheimer e Parkinson, tem sido objeto de estudos. Pesquisas, como o estudo de Heneka et al., publicado na revista Cell Metabolism (2013), exploraram o papel do inflamassoma na neuroinflamação e na patogênese dessas doenças, destacando a possível ligação entre a ativação do inflamassoma e o processo neurodegenerativo.
A compreensão do inflamassoma como um regulador-chave na patogênese de diversas doenças crônicas é fundamental para o desenvolvimento de terapias e intervenções voltadas para atenuar sua ativação e, assim, reduzir a incidência e o impacto dessas condições na saúde humana.
Papel do sistema endocanabinoide expandido
O sistema endocanabinoide expandido, composto por endocanabinoides, enzimas de degradação, receptores e neurotransmissores, desempenha um papel crucial na regulação do metabolismo, apetite e armazenamento de energia. Esse sistema é um regulador complexo que influencia vários processos fisiológicos, incluindo sua associação com obesidade e distúrbios metabólicos (Figura 7).
Endocanabinoides: os principais endocanabinoides, como anandamida (AEA) e 2-araquidonilglicerol (2AG), são compostos lipídicos que agem como ligantes endógenos dos receptores canabinoides. Eles desempenham um papel central na regulação do apetite, metabolismo energético e homeostase geral.
Enzimas de degradação: enzimas como a amida hidrolase de ácidos graxos (FAAH) e a monoacilglicerol lipase (MAGL) são responsáveis pela degradação dos endocanabinoides. Elas controlam os níveis desses compostos no organismo, influenciando diretamente a sinalização dos receptores canabinoides.
Receptores: os receptores canabinoides CB1 e CB2 estão amplamente distribuídos no corpo e são os principais alvos dos endocanabinoides. O CB1 é abundantemente expresso no sistema nervoso central, enquanto o CB2 está principalmente presente no sistema imunológico. A ativação desses receptores desempenha um papel na regulação do apetite, metabolismo e inflamação.
Neurotransmissores: o sistema endocanabinoide também interage com vários neurotransmissores, como o GABA, glutamato, dopamina e serotonina. Essas interações desempenham um papel fundamental na regulação do humor, apetite e processos cognitivos.
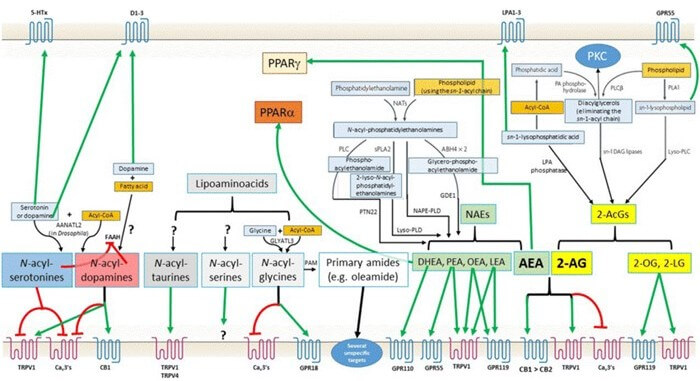
Estudos, como o de Quarta et al., publicado na revista Frontiers in Endocrinology (2019), destacam a interconexão entre o sistema endocanabinoide e a obesidade. A ativação do sistema endocanabinoide, especialmente do CB1, está associada ao aumento do apetite e ao armazenamento de gordura, o que pode contribuir para o desenvolvimento da obesidade.
Além disso, pesquisas como o estudo de Tam et al., encontrado na revista Cell Metabolism (2012), exploram a relação entre o sistema endocanabinoide e distúrbios metabólicos. A desregulação do sistema endocanabinoide pode levar a disfunções no metabolismo da glicose e ao desenvolvimento de resistência à insulina.
É essencial compreender as implicações do sistema endocanabinoide expandido na regulação do peso corporal e na fisiopatologia das doenças metabólicas. Uma compreensão mais aprofundada desse sistema pode abrir novas possibilidades terapêuticas no tratamento da obesidade e de distúrbios metabólicos associados.
Potencial terapêutico da cannabis medicinal na gestão da obesidade e distúrbios metabólicos: evidências e perspectivas
A utilização terapêutica da cannabis medicinal na gestão da obesidade e de distúrbios metabólicos tem sido objeto de crescente interesse na comunidade científica, devido às propriedades dos canabinoides e seu potencial impacto nos sistemas fisiológicos do corpo humano.
Estudos pré-clínicos e clínicos têm fornecido evidências que sugerem a possível eficácia da cannabis medicinal na gestão da obesidade e de distúrbios metabólicos.
Os canabinoides presentes na cannabis, em especial o THC e o CBD, demonstraram influenciar variados aspectos fisiológicos, como apetite, metabolismo e armazenamento de gordura, mostrando potencial terapêutico.
O THC, por exemplo, tem sido associado ao aumento de apetite, o que poderia ser benéfico em certas condições clínicas em que a perda de apetite é um problema, embora isso possa ser indesejável em casos de obesidade.
Por outro lado, estudos sugerem que o CBD pode ter um efeito redutor do apetite e influenciar a lipogênese, o que poderia ser vantajoso na gestão do peso corporal e distúrbios metabólicos.
Além disso, a regulação do metabolismo lipídico e o impacto dos canabinoides no tecido adiposo são áreas de estudo em evolução. Pesquisas indicam que os canabinoides podem modular processos metabólicos envolvidos na formação e degradação de gordura. Essa capacidade de influenciar o metabolismo pode ter implicações terapêuticas na gestão da obesidade e distúrbios relacionados.
No entanto, é importante ressaltar que as evidências disponíveis atualmente são variadas e frequentemente contraditórias. Enquanto algumas pesquisas apontam para o potencial terapêutico da cannabis medicinal na gestão da obesidade e distúrbios metabólicos, outras indicam efeitos adversos, evidenciando a falta de consistência nas respostas individuais e a necessidade de estudos mais amplos e controlados.
Utilidade terapêutica do fitocanabinoide tetrahidrocanabivarina (THCV) no manejo de doenças metabólicas
A utilização terapêutica da cannabis medicinal, especialmente incluindo a tetrahidrocanabivarina (THCV), na gestão da obesidade e distúrbios metabólicos tem despertado interesse devido às propriedades dos canabinoides e seu potencial impacto nos sistemas fisiológicos do corpo humano.
Estudos pré-clínicos e clínicos têm fornecido evidências que sugerem a possível eficácia do THCV, um canabinoide menos conhecido, na gestão da obesidade e de distúrbios metabólicos.
Enquanto o THC tem sido associado ao aumento do apetite, o THCV, ao contrário, demonstrou potencial para suprimir o apetite e influenciar o metabolismo. Pesquisas indicam que o THCV pode reduzir a ingestão de alimentos e modular a termogênese, contribuindo para a redução de peso corporal.
Além disso, a regulação do metabolismo lipídico e o impacto dos canabinoides no tecido adiposo são áreas de estudo em evolução, sendo que o THCV tem sido um foco dessa investigação. Pesquisas iniciais sugerem que o THCV pode influenciar positivamente o metabolismo dos lipídios e a adipogênese, apresentando potencial terapêutico na gestão da obesidade e distúrbios metabólicos.
No entanto, é crucial ressaltar que as evidências disponíveis sobre o THCV ainda estão em estágios iniciais de investigação. Embora sejam promissoras, as pesquisas sobre o THCV e seu impacto na gestão da obesidade e distúrbios metabólicos precisam de mais estudos e de uma compreensão aprofundada de seus efeitos específicos, dosagens e possíveis interações com outros sistemas fisiológicos.
Apesar do potencial terapêutico da cannabis medicinal, incluindo o THCV, é essencial abordar as questões éticas, legais e de segurança em relação ao seu uso a longo prazo. O desenvolvimento de estratégias terapêuticas que envolvem o THCV para a gestão da obesidade e distúrbios metabólicos requer mais investigação, para fornecer um entendimento completo de seu potencial terapêutico, apesar de seu uso mostrar-se bastante promissor.
Cannabis na redução do peso corporal e melhoria dos marcadores metabólicos: uma revisão de estudos clínicos
A utilização da cannabis e seus compostos na redução do peso corporal e melhoria dos marcadores metabólicos têm sido foco de pesquisas clínicas significativas.
Estudos têm explorado os efeitos da cannabis, especialmente de seus canabinoides, no metabolismo e no peso corporal, fornecendo insights valiosos para potenciais aplicações terapêuticas.
Estudos sobre cannabis e redução do peso corporal: pesquisas têm examinado a relação entre o uso de cannabis e o peso corporal. Um estudo publicado na revista Obesity, por Foltin e Fischman, em 1988, examinou os efeitos agudos do THC na ingestão alimentar e no peso corporal. Descobriu-se que o THC aumentou a ingestão de calorias, mas não teve um efeito significativo na redução do peso corporal. No entanto, outros estudos, como o de Le Foll et al., publicado no American Journal of Epidemiology, em 2013, indicam uma associação entre o uso de cannabis e um menor índice de massa corporal (IMC).
Melhoria dos marcadores metabólicos: além do peso corporal, a cannabis tem sido investigada em relação à melhoria dos marcadores metabólicos. Um estudo clínico conduzido por Jadoon et al., publicado na revista Diabetes Care, em 2016, examinou os efeitos do canabidiol (CBD) e da tetraidrocanabivarina (THCV) nos parâmetros glicêmicos e lipídicos de pacientes com diabetes do tipo 2. Os resultados indicaram que o CBD e o THCV podem ter efeitos benéficos na redução da resistência à insulina e na melhoria dos níveis lipídicos.
Efeitos na saúde metabólica e cardiovascular: estudos adicionais, como o de Wargent et al., divulgado em Nutrition & Diabetes, em 2013, observaram que o THCV pode melhorar a sensibilidade à insulina em modelos de obesidade. Essas descobertas sugerem que os canabinoides podem desempenhar um papel na regulação da glicose e do metabolismo lipídico.
É importante ressaltar que, apesar das evidências positivas observadas em alguns estudos, a relação entre a cannabis e a redução do peso corporal, bem como a melhoria dos marcadores metabólicos, é complexa e os resultados ainda não são conclusivos.
Além disso, questões relativas a dosagem, interações com outros medicamentos e possíveis efeitos adversos precisam ser consideradas.
Pesquisas clínicas sobre o uso da cannabis na redução do peso corporal e na melhoria dos marcadores metabólicos estão em andamento e continuam a fornecer informações valiosas. No entanto, mais estudos são necessários para esclarecer a eficácia e segurança a longo prazo do uso terapêutico da cannabis nesse contexto.
Liberação dos produtos derivados de cannabis medicinal no Brasil: a evolução regulatória e suas implicações clínicas
O uso de produtos derivados de cannabis, no Brasil, já é autorizado pela Agência Nacional de Vigilância Sanitária (Anvisa) desde 2014, através da Resolução da Diretoria Colegiada (RDC) nº 660, posteriormente ampliada com a RDC nº 327, em 2019.
A regulamentação do uso de produtos derivados de cannabis medicinal no País tem sido um tópico de crescente relevância. Como dito acima, a Anvisa deu início a esse processo com a publicação da RDC nº 660/2014, que autorizou a prescrição e o uso de medicamentos à base de canabidiol (CBD), em casos específicos. Desde então, a regulamentação evoluiu com a publicação da RDC nº 327/2019, que expandiu o acesso a produtos derivados de cannabis para pacientes com condições médicas diversas. Além disso, o conceito de “uso compassivo” também foi introduzido, permitindo o acesso a esses produtos em situações de saúde críticas.
Inicialmente, as indicações para o uso de produtos derivados de cannabis eram restritas e direcionadas a pacientes com condições médicas específicas, como epilepsia refratária (síndrome de Dravet, síndrome de Lenox-Gastaut e esclerose tuberosa), sendo também permitido tratar a espasticidade causada por esclerose múltipla e náuseas e vômitos causados por qimioterapia.
Os produtos com uso autorizado continham predominantemente CBD (produtos full spectrum com quantidade de THC menor do que 0,3%) e tinham que ser obrigatoriamente importados diretamente para o paciente.
A introdução do conceito de “uso compassivo” ampliou as possibilidades de acesso a produtos derivados de cannabis medicinal, no Brasil, permitindo que pacientes com condições médicas graves, mas que não se enquadram necessariamente nas indicações iniciais, pudessem obter esses produtos mediante autorização médica e aprovação da Anvisa. Esse enfoque compassivo reflete a compreensão de que a cannabis medicinal pode oferecer benefícios terapêuticos em uma variedade de condições, além daquelas inicialmente previstas.
Portanto, a prescrição de produtos derivados de cannabis medicinal está autorizada sempre que o paciente tiver queixas, sinais e sintomas que não melhoram com nenhum outro tratamento convencional.
A evolução da regulamentação resultou em impactos clínicos significativos. Muitos pacientes que não respondiam adequadamente a terapias convencionais encontraram alívio em produtos derivados de cannabis. No entanto, também surgiram desafios, incluindo a necessidade de educar profissionais de saúde e de garantir a qualidade e segurança dos produtos, bem como a possibilidade de acesso equitativo, uma vez que esses produtos têm um custo elevado, não sendo acessível a toda a população.
Atualmente, no Brasil, médicos e odontólogos podem prescrever produtos derivados de cannabis medicinal, para as mais diversas condições. Além de contar com a importação, o País já disponibiliza mais de 27 marcas de produtos à venda nas grandes redes de drogarias, bem como aqueles fornecidos pelas associações de cultivo para pacientes, que possuem autorização judicial para plantar e extrair o óleo. Essas são as formas hoje disponíveis no Brasil para obtenção dos produtos à base de cannabis medicinal.
Essa evolução tem proporcionado alívio a muitos pacientes com condições médicas diversas. Entretanto, o caminho ainda é permeado por desafios regulatórios, científicos e clínicos que requerem atenção contínua, para que se possa otimizar o uso terapêutico da cannabis e expandir seu potencial benefício para a saúde pública.
Profa. Dra. Paula Pileggi Vinha – CRM/SP: 99415. Nutróloga (RQE: 26929) e PhD e mestre em Clínica Médica, pela Faculdade de Medicina de Ribeirão Preto – FMRP/USP. Estudiosa e pesquisadora de cannabis medicinal desde 2017 e membro do Laboratório de Ciências Morfológicas e Moleculares da Unicamp – Divisão de Medicina Canabinoide – NCANN-LCIMM e da Associação Pan-Americana de Medicina Canabinoide – APMC, Associação Médica Brasileira de Endocanabinologia – AMBCANN, Society of Cannabis Clinicians – EUA e International Cannabinoid Research Society – ICRS. Professora convidada da Universidade Federal de São Paulo – Unifesp e da Universidade Federal de Santa Catarina – UFSC. Diretora técnica da Clínica Paula Vinha, em São Paulo e da 2Seeds Hempminds Educação e Treinamento. Coordenadora científica da Conferência Internacional da Cannabis Medicinal – CICMED, em São Paulo, em agosto de 2022/23.
Referências bibliográficas
Argueta, D. A., DiPatrizio, N. V., Martin, G. G., & Young, J. W. (2019). High-fructose corn syrup induces obesity and alters the inflammatory response to sepsis in mice. Journal of the American Heart Association, 8(7), e011690.
Brice Ayissi Owona, Wilfred Angie Abia, Paul Fewou Moundipa, Natural compounds flavonoids as modulators of inflammasomes in chronic diseases, International Immunopharmacology, Volume 84, 2020,106498.
Campos, A. C., Moreira, F. A., Gomes, F. V., Del Bel, E. A., & Guimarães, F. S. (2012). Multiple mechanisms involved in the large-spectrum therapeutic potential of cannabidiol in psychiatric disorders. Philosophical Transactions of the Royal Society B: Biological Sciences, 367(1607), 3364-3378.
Cota, D., Marsicano, G., Tschöp, M., Grübler, Y., Flachskamm, C., Schubert, M., … & Pagotto, U. (2003). The endogenous cannabinoid system affects energy balance via central orexigenic drive and peripheral lipogenesis. The Journal of Clinical Investigation, 112(3), 423-431.
Christensen R, Kristensen PK, Bartels EM, Bliddal H, Astrup A. Efficacy and safety of the weight-loss drug rimonabant: a meta-analysis of randomised trials. Lancet. 2007;370(9600):1706-13. doi:10.1016/s0140-6736(07)61721-8.
Crippa, J. A., Derenusson, G. N., Ferrari, T. B., Wichert-Ana, L., Duran, F. L., Martin-Santos, R., … & Filho, A. S. (2011). Neural basis of anxiolytic effects of cannabidiol (CBD) in generalized social anxiety disorder: a preliminary report. Journal of Psychopharmacology, 25(1), 121-130.
Cristino, L., Bisogno, T., Di Marzo, V. (2020). Cannabinoids and the expanded endocannabinoid system in neurological disorders. Nature Reviews Neurology, 16(1), 9-29.
Després, J. P. (2012). Cardiovascular disease under the influence of excess visceral fat. Critical Pathways in Cardiology, 11(3), 142-148.
Di Marzo, V., Goparaju, S. K., Wang, L., Liu, J., Bátkai, S., Járai, Z., … & Kunos, G. (2001). Leptin-regulated endocannabinoids are involved in maintaining food intake. Nature, 410(6830), 822-825.
Di Marzo, V., & Piscitelli, F. (2015). The endocannabinoid system and its modulation by phytocannabinoids. Neurotherapeutics, 12(4), 692-698.
Di Marzo, V. (2008). Targeting the endocannabinoid system: to enhance or reduce? Nature Reviews Drug Discovery, 7(5), 438-455.
Engeli, S., Böhnke, J., Feldpausch, M., Gorzelniak, K., Janke, J., Bátkai, S., … & Jordan, J. (2005). Activation of the peripheral endocannabinoid system in human obesity. Diabetes, 54(10), 2838-2843.
Englund, A., Morrison, P. D., Nottage, J., Hague, D., Kane, F., Bonaccorso, S., & Feilding, A. (2013). Cannabidiol inhibits THC-elicited paranoid symptoms and hippocampal-dependent memory impairment. Journal of Psychopharmacology, 27(1), 19-27.
Foltin, R. W., & Fischman, M. W. (1988). Effects of smoked marijuana on food intake and body weight of humans living in a residential laboratory. Appetite, 11(1), 1-14.
Heneka, M. T., Kummer, M. P., Stutz, A., Delekate, A., Schwartz, S., Vieira-Saecker, A., … & Golenbock, D. T. (2013). NLRP3 is activated in Alzheimer’s disease and contributes to pathology in APP/PS1 mice. Nature, 493(7434), 674-678.
Hirsch S, Hinden L, Naim MB, et al. Hepatic targeting of the centrally active cannabinoid 1 receptor (CB1R) blocker rimonabant via PLGA nanoparticles for treating fatty liver disease and diabetes. J Control Release. 2023;353:254-269. doi:10.1016/j.jconrel.2022.11.040.
Hruby, A., & Hu, F. B. (2015). The epidemiology of obesity: a big picture. PharmacoEconomics, 33(7), 673-689.
Jadoon, K. A., Ratcliffe, S. H., Barrett, D. A., Thomas, E. L., Stott, C., Bell, J. D., & Tan, G. D. (2016). Efficacy and safety of cannabidiol and tetrahydrocannabivarin on glycemic and lipid parameters in patients with type 2 diabetes: a randomized, double-blind, placebo-controlled, parallel group pilot study. Diabetes Care, 39(10), 1777-1786.
Le Foll, B., Trigo, J. M., Sharkey, K. A., & Le Strat, Y. (2013). Cannabis and Δ9-tetrahydrocannabinol (THC) for weight loss?. The American Journal of Epidemiology, 177(4), 305-311.
Massa, F., Aiello, C., Alfiere, S., … Morano, S. (2019). Endocannabinoid signaling in the adipose tissue‐liver crosstalk in high‐fat diet‐induced obesity: The role of trans‐caryophyllene. Nutrients, 11(12), 2911.
Matias, I., Gonthier, M. P., Petrosino, S., Docimo, L., Capasso, R., Hoareau, L., … & Di Marzo, V. (2007). Role and regulation of acylethanolamides in energy balance: focus on adipocytes and beta-cells. British Journal of Pharmacology, 152(5), 676-690.
Mechoulam, R., Parker, L. A., & Gallily, R. (2002). Cannabidiol: an overview of some pharmacological aspects. The Journal of Clinical Pharmacology, 42(S1), 11S-19S.
NCD Risk Factor Collaboration. (2016). Trends in adult body-mass index in 200 countries from 1975 to 2014: a pooled analysis of 1698 population-based measurement studies with 19.2 million participants. The Lancet, 387(10026), 1377-1396.
Pagotto, U., Marsicano, G., Cota, D., Lutz, B., & Pasquali, R. (2006). The emerging role of the endocannabinoid system in endocrine regulation and energy balance. Endocrine Reviews, 27(1), 73-100.Parte superior do formulário
Paiva-Oliveira, E.L. et al. Inflamassoma e sua repercussão clínica: revisão da literatura. R. Ci. med. biol., Salvador, v.11, n.1, p.96-102, jan./abr. 2012.
Pi-Sunyer FX, Aronne LJ, Heshmati HM, et al. Effect of rimonabant, a cannabinoid-1 receptor blocker, on weight and cardiometabolic risk factors in overweight or obese patients: RIO-North America: a randomized controlled trial.
JAMA. 2006;295(7):761-75. doi:10.1001/jama.295.7.761.
Quarta, C., Mazier, W., Albéri, L., & Maccarrone, M. (2019). The expanded endocannabinoid system/ome: Complex, multi-affected and multi-effectual. Frontiers in Endocrinology, 10, 152.
Ridker, P. M., Everett, B. M., Thuren, T., MacFadyen, J. G., Chang, W. H., Ballantyne, C., … & Group, C. (2017). Antiinflammatory therapy with canakinumab for atherosclerotic disease. New England Journal of Medicine, 377(12), 1119-1131.
Sam AH, Salem V, Ghatei MA. Rimonabant: From RIO to ban. J Obes. 2011;2011:432607. doi:10.1155/2011/432607.
Simopoulos, AP. Omega 3 Fatty Acids in inflammation and autoimmune diseases. Journal os American College of Nutrition. Vol 21, nº 6, 495-505 (2002). Martin, CA; Almeida, VV; Ruiz, MR; Visentainer, JE; Matshushita, M; Souza, NEI; Visentainer, JV. Ácidos graxos poliinsaturados ômega-3 e ômega-6: importância e ocorrência em alimentos. Rev. Nutr. vol.19 nº.6 Campinas Nov./Dec (2006).
Silvestri, C., & Di Marzo, V. (2013). The endocannabinoid system in energy homeostasis and the etiopathology of metabolic disorders. Cell Metabolism, 17(4), 475-490.
Silvestri, C., Paris, D., Martella, A., Melck, D., Guadagnino, I., Cawthorne, M., … & Di Marzo, V. (2015). Two non-psychoactive cannabinoids reduce intracellular lipid levels and inhibit hepatosteatosis. Journal of Hepatology, 62(6), 1382-1390.
Strowig, T., Henao-Mejia, J., Elinav, E., & Flavell, R. (2012). Inflammasomes in health and disease. Nature, 481(7381), 278-286.
Tam, J., Cinar, R., Liu, J., Godlewski, G., Wesley, D., Jourdan, T., … & Kunos, G. (2012). Peripheral cannabinoid-1 receptor inverse agonism reduces obesity by reversing leptin resistance. Cell Metabolism, 16(2), 167-179.Parte superior do formulário
Vandanmagsar, B., Youm, Y. H., Ravussin, A., Galgani, J. E., Stadler, K., Mynatt, R. L., … & Dixit, V. D. (2011). The NLRP3 inflammasome instigates obesity-induced inflammation and insulin resistance. Nature Medicine, 17(2), 179-188.
Wargent, E. T., Zaibi, M. S., Silvestri, C., Hislop, D. C., Stocker, C. J., Stott, C. G., … & Cawthorne, M. A. (2013). The cannabinoid Δ9-tetrahydrocannabivarin (THCV) ameliorates insulin sensitivity in two mouse models of obesity. Nutrition & Diabetes, 3(5), e68.
World Health Organization (WHO). (2018). Obesity and overweight. Disponível em: https://www.who.int/news-room/fact-sheets/detail/obesity-and-overweight.

