Durante os últimos anos, os estudos sobre a microbiota humana têm apresentado uma importância crescente.
O desenvolvimento da tecnologia baseada em sequenciamento genético tornou possível identificar um grande número de espécies bacterianas que anteriormente estavam fora do escopo das tecnologias baseadas em cultura.
Da mesma forma como o diagnóstico da microbiota emergiu como um foco importante na ciência, a medicina reprodutiva tornou-se um tópico significativo, principalmente no que diz respeito à pesquisa causal e opções de tratamento para falhas de implantação embrionária (insucesso no processo de fixação do embrião ou embriões no endométrio, que é a camada vascularizada que reveste o útero internamente, frustando a possibilidade de uma gestação).
A microbiota vaginal, também conhecida como flora vaginal, é o microecossistema formado pela associação dos diversos microrganismos presentes na vagina e compostos antimicrobianos produzidos pelos mesmos, responsáveis por estabilizar o pH vaginal.
O microbioma vaginal é, portanto, identificado como um fator que influencia a infertilidade e um alvo promissor para opções de tratamento nessa área.
Este artigo fornece uma visão geral das pesquisas atuais sobre o impacto da microbiota vaginal no resultado das medidas reprodutivas.
Foi demonstrado que uma microbiota não dominada por lactobacilos está associada à disbiose e, possivelmente até à vaginose bacteriana. Esse desequilíbrio tem um impacto negativo nas taxas de implantação embrionária em tecnologias de reprodução assistida e também pode ser responsável por abortos habituais.
Sendo assim, a triagem da microbiota em combinação com o tratamento com antibióticos e/ou probióticos parece ser uma forma de melhorar os resultados da gravidez.
As tecnologias de reprodução assistida são uma opção de tratamento comum e promissora para casais que lutam contra a infertilidade.
Embora o sucesso dessas tecnologias seja influenciado por várias condições técnicas, o verdadeiro potencial reprodutivo é definido pela qualidade do oócito (célula feminina que está prestes a converter-se num óvulo maduro), do esperma e do ambiente materno, que dá suporte à implantação e ao desenvolvimento contínuo do embrião. Há, portanto, três ambientes fisiológicos únicos envolvidos nesse processo.
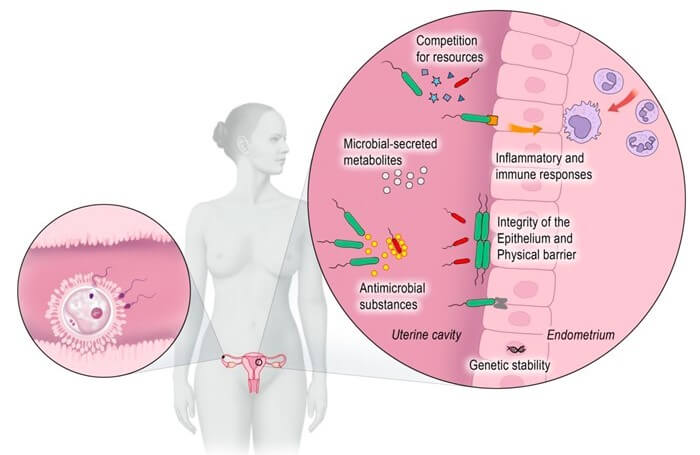
No entanto, os fatores cruciais responsáveis pelo sucesso da implantação embrionária são o endométrio, seu microbioma e os aspectos imunológicos (Figura 1).
Microbioma ou microbiota?
À medida que fomos adquirindo mais conhecimento sobre a microbiota humana, tornou-se evidente como ela afeta a função fisiológica de praticamente todos os órgãos colonizados por bactérias(1).
Bilhões de microrganismos, como bactérias, archaea, fungos, bacteriófagos e vírus, colonizam o corpo humano(2).Os primeiros estudos sobre bactérias não patogênicas que colonizam o oraganismo foram sobre Escherichia coli no intestino de crianças saudáveis, publicados em 1885(3).
Mais tarde, durante o século XX, foram descobertas outras bactérias comensais (bactérias que vivem em harmonia com o hospedeiro) que habitam diferentes partes do corpo humano, como as cavidades nasal e oral, a pele e o trato urogenital(3).
Inicialmente, o papel dos chamados micróbios foi subestimado, sendo que, em geral, eram considerados uma ameaça à saúde humana.Em 1988, Whipps e colaboradores definiram o termo microbiota como sendo “uma comunidade microbiana característica que ocupa um habitat razoavelmente bem definido e possui propriedades fisicoquímicas distintas”.
Atualmente, essa definição é enriquecida por uma visão dinâmica das atividades microbianas que resultam em nichos ecológicos(4).
É importante distinguir entre os termos microbiota e microbioma. A microbiota refere-se a uma comunidade de microrganismos presentes em um determinado ambiente, enquanto microbioma descreve uma comunidade de microrganismos e seu papel dentro de um determinado ambiente, levando em consideração as condições ambientais e sua interação mútua.
Microbiotas vaginal, endometrial e urogenital
Cerca de 80% do total da microbiota humana reside no trato intestinal e 9%, no trato urogenital(5-6).
O trato urinário era anteriormente considerado como um nicho corporal estéril, mas hoje já se sabe que comunidades bacterianas específicas desse trato são responsáveis por um ambiente urinário saudável.
Alterações nessa microbiota estão relacionadas a distúrbios urológicos, como incontinência urinária, tumores urológicos e disfunção da bexiga neurogênica(7).
Já, na microbiota vaginal, a comunidade microbiana é dominada pelos lactobacilos, que são comumente associados a um estado geniturinário saudável.
Os lactobacilos produzem ácido láctico e protegem a vagina mantendo um pH baixo, que é proibitivo para o crescimento da maioria das bactérias.
A cavidade uterina era anteriormente considerada como um órgão estéril. Mas hoje se sabe que ela possui uma microbiota própria e específica, que é 100 a 1000 vezes menos densa(8), mas dominada por uma variedade maior de espécies bacterianas e diferentes cepas de lactobacilos do que a microbiota vaginal saudável(3-9).
As bactérias presentes no útero defendem o corpo contra infecções e desempenham um papel significativo nos resultados reprodutivos, como os relativos às taxas de implantação embrionária e parto prematuro(10).
O microbioma vaginal é de grande interesse devido à sua complexidade e ao conhecimento crescente sobre o seu papel na saúde da mulher e seu impacto na reprodução humana(11).
Apesar da existência e importância das microbiotas endometrial e urogenital, neste artigo levou-se em consideração tão somente o papel da microbiota vaginal em medicina reprodutiva, buscando-se analisar as evidências atuais sobre seu impacto e possíveis opções de tratamento para disbiose, falha de implantação embrionária e aborto recorrente.
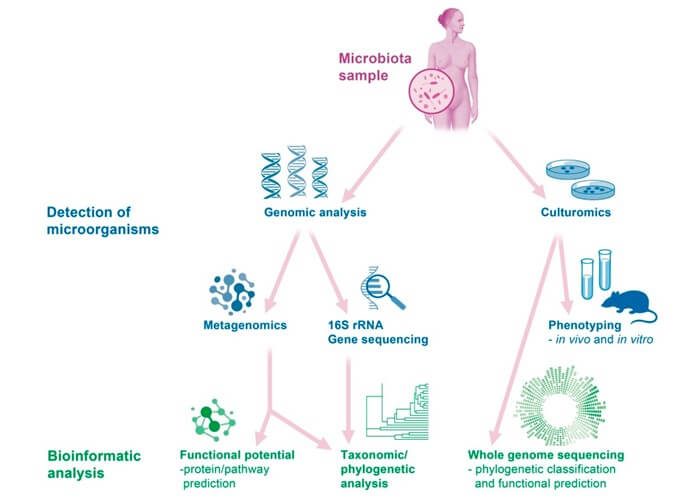
Diagnóstico das microbiotas: cultura vs. sequenciamento genético
Os dados do microbioma podem ser obtidos por tecnologia baseada em cultura ou em sequenciamento genético.
Grande parte do trabalho inicial de descrição da microbiota humana decorre de abordagens baseadas em cultura. Após um certo período de cultivo, uma variedade de espécies bacterianas pode ser identificada com o uso de coloração celular característica, morfologia ou reações bioquímicas observadas(12).
Os métodos baseados em cultura são demorados e fornecem informações exclusivamente sobre as bactérias cujos substratos metabólicos são fornecidos pelo meio de cultivo(13). Portanto, muitos microrganismos não podem ser identificados através dessas técnicas, o que leva o pesquisador a subestimar a diversidade da respectiva microbiota.
Os dados baseados em cultura, embora permaneçam informativos, devem ser interpretados dentro das limitações da respectiva tecnologia.
Contudo, as técnicas clássicas de cultura continuam a desempenhar um papel vital na rotina clínica. Além de estarem mais facilmente disponíveis e acessíveis – fator que não deve ser subestimado – as técnicas de cultura têm a principal vantagem de revelar mais características fenotípicas, que são de interesse para a tomada de decisão clínica.
No entanto, devido às inúmeras limitações inerentes ao processo de cultivo, muitas informações sobre as diferentes comunidades microbianas presentes no trato genital, como suas interdependências, permanecem indefinidas(14).
Métodos moleculares podem ser usados para detectar bactérias não cultiváveis da microbiota vaginal(15-16). O sequenciamento de genes relacionados ao RNA ribossômico 16S (rRNA) alterou a abordagem utilizada para se estudar a microbiota(17). Especificamente, o rRNA 16S é um componente da pequena subunidade 30S de um ribossomo procariótico, sendo que os genes que codificam esse componente são usados para reconstruir filogenias devido à sua lenta taxa de evolução genômica(17). Em particular, regiões hipervariáveis dentro do gene, que servem como impressões digitais moleculares, podem ser usadas para identificar gênero e nível de espécie(18-19).
Essa tecnologia baseada em sequenciamento permite a detecção de microrganismos por extração direta e clonagem de DNA de um grupo de organismos, a fim de se obter mais informações sobre a fisiologia e a ecologia do microbioma(1).
A metagenômica representa todo o genoma de todos os microrganismos em um ambiente definido, enquanto a genômica unicelular refere-se aos genomas de células únicas que podem ou não conter todo o repertório genético na microbiota.
O sucesso desses estudos que independem de cultura deve-se principalmente à qualidade e quantidade de DNA metagenômico isolado das amostras fornecidas. Assim, isolar DNA metagenômico de boa qualidade de uma fonte heterogênea, como fezes humanas ou microbiota vaginal, tem sido uma tarefa desafiadora(20). A Figura 2 mostra uma visão geral de algumas das técnicas mais comuns usadas para analisar o microbioma vaginal.
Conclusões
Os dados atualmente disponíveis na literatura científica mostram uma correlação entre o microbioma genital (especialmente vaginal e endometrial) e o sucesso das tecnologias de reprodução assistida.
A disbiose, a vaginose bacteriana ou a ausência de algumas espécies de lactobacilos podem levar ao fracasso da implantação embrionária.
Uma interação complexa de cepas de lactobacilos desempenha um papel importante no equilíbrio da flora vaginal saudável, enquanto o Lactobacillus crispatus parece proteger o corpo contra a vaginose bacteriana, tendo um efeito positivo na fertilidade.
Além disso, a ausência de flora dominada por lactobacilos no endométrio parece estar relacionada a falhas recorrentes de implantação embrionária.
Assim, uma triagem de desequilíbrio da microbiota vaginal pode se tornar um novo alvo de estudos, de forma a fornecer opções terapêuticas eficazes.
A terapia individualizada, incluindo o uso de antibióticos e/ou probióticos ou ácidos lácticos, pode alterar a microbiota vaginal e endometrial e levar a maiores taxas de gravidez em tecnologias de reprodução assistida.
No entanto, mais estudos serão necessários para se obter maiores informações sobre desenhos e protocolos padronizados de pesquisas, métodos e tamanhos de amostragem e técnicas de sequenciamento genético. Estudos comparáveis servirão de base para o desenvolvimento de terapias eficazes.
Diana Yedid – Diretora científica e administradora, na DYD Medicina Integrativa, em Milão, na Itália, atuando nas áreas de aconselhamento, formação, cursos, pesquisas e ensaios clínicos em obstetrícia, ginecologia, uroandrologia, pediatria, endocrinologia, gastroenterologia e neurologia. É especialista em Fitoterapia, Micronutrição, Terapia Floral e outras práticas integrativas.
Nota: elaborado com base no artigo Vaginal Microbiome in Reproductive Medicine, publicado em MDPI Diagnostics, em agosto de 2022.
Referências bibliográficas
1 – Franasiak, J. M.; Scott, R. T. Jr. Reproductive tract microbiome in assisted reproductive technologies. Fertil. Steril. 2015, 104, 1364–1371.
2 – Gagliardi, A.; Totino, V.; Cacciotti, F.; Iebba, V.; Neroni, B.; Bonfiglio, G.; Schippa, S. Rebuilding the Gut Microbiota Ecosystem. Int. J. Environ. Res. Public Health 2018, 15, 1679.
3 – Garcia-Velasco, J. A.; Budding, D.; Campe, H.; Malfertheiner, S. F.; Hamamah, S.; Santjohanser, C.; Schuppe-Koistinen, I.; Nielsen, H. S.; Vieira-Silva, S.; Laven, J. The reproductive microbiome – Clinical practice recommendations for fertility specialists. Reprod. Biomed. Online 2020, 41, 443–453.
4 – Whipps, J. M.; Lewis, K.; Cooke, R. C. Mycoparasitism and plant disease control. In Fungi in Biological Control Systems; Burge, N.M., Ed.; Manchester University Press: Manchester, UK, 1988; p. 176.
5 – Sirota, I.; Zarek, S. M.; Segars, J. H. Potential Influence of the Microbiome on Infertility and Assisted Reproductive Technology. Semin. Reprod. Med. 2014, 32, 35–42.
6 – Moreno, I.; Codoner, F. M.; Vilella, F.; Valbuena, D.; Martinez-Blanch, J. F.; Jimenez-Almazan, J.; Alonso, R.; Alama, P.; Remohi, J.; Pellicer, A. Evidence that the endometrial microbiota has an effect on implantation success or failure. Am. J. Obstet. Gynecol. 2016, 215, 684–703.
7 – Aragon, I. M.; Herrera-Imbroda, B.; Queipo-Ortuno, M. I.; Castillo, E.; del Moral, J. S.; Gomez-Millan, J.; Yucel, G.; Lara, M. F. The Urinary Tract Microbiome in Health and Disease. Eur. Urol. Focus 2018, 4, 128–138.
8 – Baker, J. M.; Chase, D. M.; Herbst-Kralovetz, M. M. Uterine Microbiota: Residents, Tourists, or Invaders? Front. Immunol. 2018, 9, 208.
9 – Moreno, I.; Franasiak, J. M. Endometrial microbiota – New player in town. Fertil. Steril. 2017, 108, 32–39.
10 – The Integrative HMP (iHMP) Research Network Consortium. The Integrative Human Microbiome Project. Nature 2019, 569, 641–648.
11 – Moreno, I.; Simon, C. Deciphering the effect of reproductive tract microbiota on human reproduction. Reprod. Med. Biol. 2019, 18, 40–50.
12 – Hok, T. T.; Loen, L. K.; Tjiat, N. T. Comparative bacteriology of the endocervical mucus. Am. J. Obstet. Gynecol. 1967, 98, 781–783.
13 – Vitale, S. G.; Loen, L. K.; Tjiat, N. T. The Role of Genital Tract Microbiome in Fertility: A Systematic Review. Int. J. Mol. Sci. 2021, 23, 180.
14 – Wolf, E. A.; Rettig, H. C.; Lupatsii, M.; Schluter, B.; Schafer, K.; Friedrich, D.; Graspeuntner, S.; Rupp, J. Culturomics Approaches Expand the Diagnostic Accuracy for Sexually Transmitted Infections. Int. J. Mol. Sci. 2021, 22, 10815.
15 – Burton, J. P.; Reid, G. Evaluation of the Bacterial Vaginal Flora of 20 Postmenopausal Women by Direct (Nugent Score) and Molecular (Polymerase Chain Reaction and Denaturing Gradient Gel Electrophoresis) Techniques. J. Infect. Dis. 2002, 186, 1770–1780.
16 – Pavlova, S. I.; Kilic, A. O.; Kilic, S. S.; So, J. S.; Nader-Macias, M. E.; Simoes, J. A.; Tao, L. Genetic diversity of vaginal lactobacilli from women in different countries based on 16S rRNA gene sequences. J. Appl. Microbiol. 2002, 92, 451–459.
17 – Yarza, P.; Yilmaz, P.; Pruesse, E.; Glockner, F. O.; Ludwig, W.; Schleifer, K. H.; Whitman, W. B.; Euzeby, J.; Amann, R.; Rossello-Mora, R. Uniting the classification of cultured and uncultured bacteria and archaea using 16S rRNA gene sequences. Nat. Rev. Microbiol. 2014, 12, 635–645.
18 – Eckburg, P. B.; Bik, E. M.; Bernstein, C. N.; Purdom, E.; Dethlefsen, L.; Sargent, M.; Gill, S. R.; Nelson, K. E.; Relman, D. A. Diversity of the human intestinal microbial flora. Science 2005, 308, 1635–1638.
19 – Hyman, R. W.; Fukushima, M.; Diamond, L.; Kumm, J.; Giudice, L. C.; Davis, R. W. Microbes on the human vaginal epithelium. Proc. Natl. Acad. Sci. USA 2005, 102, 7952–7957.
20 – Kumar, J.; Kumar, M.; Gupta, S.; Ahmed, V.; Bhambi, M.; Pandey, R.; Chauhan, N. S. An Improved Methodology to Overcome Key Issues in Human Fecal Metagenomic DNA Extraction. Genom. Proteom. Bioinform. 2016, 14, 371–378.