Espécies reativas de oxigênio (ROS) é um termo genérico para uma série de derivados de oxigênio molecular que ocorrem como uma condição normal da vida aeróbia. ROS são vitais para a manutenção da homeostase biológica, pois são fundamentais para a transmissão de informações, sinalização, imunidade, defesa e desenvolvimento. Duas espécies reativas de oxigênio, o peróxido de hidrogênio (H2O2) e o radical ânion superóxido (O2-•), são os principais agentes de sinalização redox. O H2O2, quando numa concentração na faixa de nanomolar, tem participação na regulação metabólica e apoia a adaptação celular ao ambiente. Várias outras espécies reativas estão envolvidas na sinalização redox, como por exemplo o óxido nítrico(1).
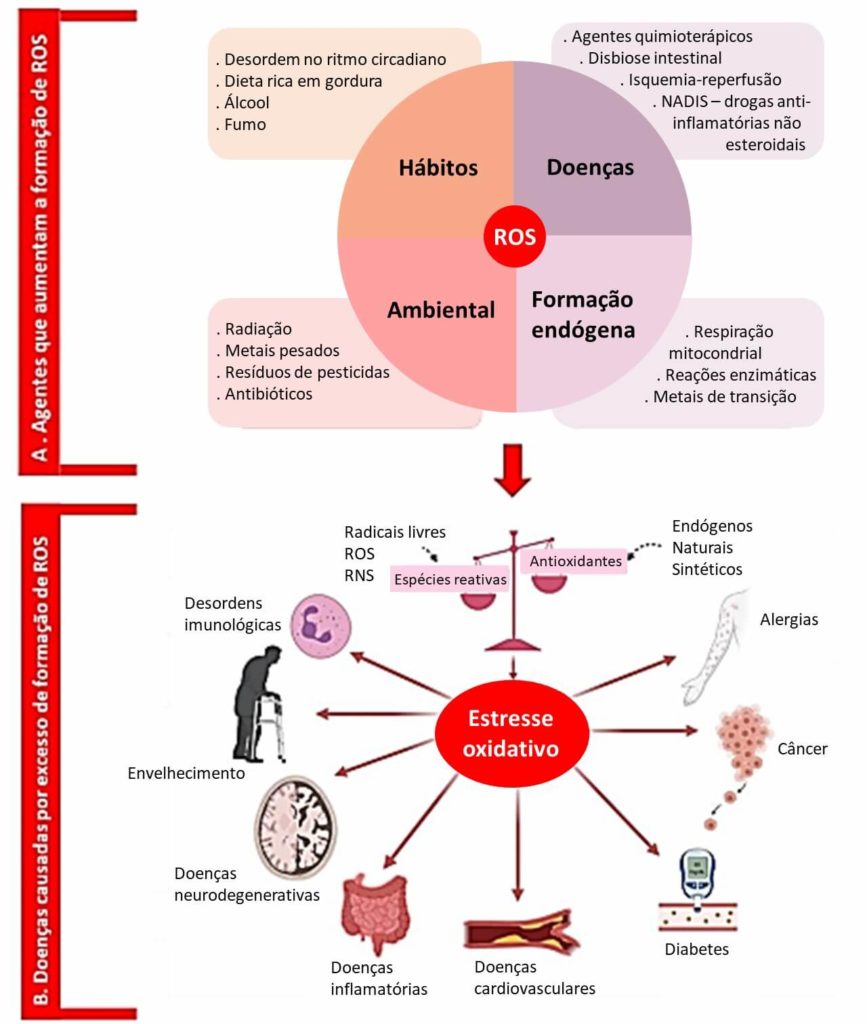
O aumento exacerbado dos níveis de diferentes ROS leva aos danos moleculares, denominados como “estresse oxidativo”. O estresse oxidativo causa a degradação de proteínas, peroxidação lipídica e oxidação do DNA e têm ligação com o processo de envelhecimento e imunosenescência(2) e com o desenvolvimento de muitas doenças crônicas relacionadas com a idade, como as neurodegenerativas (por exemplo: doença de Alzheimer)(3), diabetes(4), retinopatia diabética(5), câncer(6), cardíacas coronárias(7), oculares(8), inflamatória intestinal(9) e osteoartrite(10) , entre outras (Figura 1B).
Contudo, os mamíferos, incluindo os humanos, possuem muitos processos, poderosos e diversificados, para combater os danos por estresse. Dentre eles estão os processos antioxidantes, anti-inflamatórios e anticâncer. Nesse contexto, todo o sistema imunológico pode ser considerado como um sistema antiestresse, em que os macrófagos desempenham um papel fundamental, pois são eles, as células da imunidade inata, que detectam muitos agentes estressores simultaneamente, sendo capazes de orquestrar as respostas do corpo, incluindo a preparação da resposta imunológica adaptativa(11).
Inflamação associada à idade: “inflammaging”
A inflamação de baixo grau associada à idade foi denominada “inflammaging”(12) e é o resultado das mudanças imunológicas que acontecem no corpo em resposta a um estresse ao longo da vida, ou seja, da estimulação fisiológica crônica do sistema imunológico(13), que provoca um constante aumento no status pró-inflamatório subjacente até chegar ao fenômeno das inflamações crônicas.
Durante o processo de envelhecimento, a ativação crônica de células do sistema imunológico, como os macrófagos teciduais, células dendríticas e células T, pela sinalização de ROS, leva ao desequilíbrio redox, instabilidade genômica e transcrição de genes pró-inflamatórios, através da ativação de fatores de transcrição como o fator nuclear kappa B (NF-κB) e a liberação de citocinas, como IL-1, IL-6 e TNFα e IL-1β. Esse mecanismo complexo está diretamente relacionado com inflamação e/ou disfunção mitocondrial e contribui para a progressão de diferentes doenças decorrentes da idade(14). A inflamação crônica causada por disfunção mitocondrial e pela resposta imunológica exacerbada está relacionada ainda com a liberação explosiva de citocinas inflamatórias (tempestade de citocinas), causando pneumonia grave, falência de múltiplos órgãos e morte em pacientes com Covid-19(15).
Contudo, a sinalização de ROS também é importante para a resposta adaptativa ao próprio envelhecimento(11), pois pode induzir a ativação de fatores de transcrição genética, como Nrf2, para proteger a célula contra danos oxidativos pelo aumento da expressão de enzimas antioxidantes(14) .
Os danos causados no organismo devido ao estresse oxidativo só ocorrem quando há um desequilíbrio entre a geração e a eliminação de ROS(1). Assim, muitos esforços científicos são realizados para uma maior compreensão do controle de vias de sinalização específicas mediadas por ROS, que possam determinar um aumento da rede de adaptação, que integra todas as reações do organismo, do nível molecular ao sistema imunoneuroendócrino, levando a uma longevidade saudável. Somente quando o estresse oxidativo cruza o limiar pró-inflamatório, ou seja, quando não há mais possibilidade de conter o processo inflamatório, é que o resultado será um envelhecimento mal-sucedido/patológico, caracterizado por doenças não controladas e fragilidades que provocam o declínio funcional e morte precoce(11) .
Estratégias terapêuticas antioxidantes
Múltiplas estratégias terapêuticas antioxidantes para doenças relacionadas ao envelhecimento estão sendo exploradas. No entanto, existem várias limitações para a sua aplicação(14,16). A eliminação inespecífica de ROS pelo uso direto de compostos antioxidantes de baixa massa molecular não foi bem-sucedida em neutralizar o início e a progressão de doenças, em ensaios clínicos.
Aumentar a síntese de enzimas antioxidantes, principalmente por meio da ativação de Nrf2, utilizando polifenóis de plantas, representa uma estratégia promissora, porém com limitações terapêuticas devido à baixa biodisponibilidade, aos efeitos inespecíficos e à hormese, a qual compreende respostas bifásicas, podendo ser protetora contra o estresse oxidativo em baixas concentrações, mas deletéria quando em concentrações maiores(14, 17).
O direcionamento seletivo de controle de vias de sinalização específicas mediadas por ROS também pode ajudar a determinar a modulação de fatores ambientais coletivamente conhecidos como exposome (nutrição, estilo de vida, estresse psicossocial, xenobióticos, irradiação, etc.), pois fatores exógenos também podem contribuir para a elevação das ROS (Figura 1A).
Assim, a modulação desses fatores pode prevenir as doenças relacionadas com a idade(14). Por exemplo: exercícios físicos agudos levam a uma indução intermitente de baixos níveis de ROS, determinando uma suprarregulação de sistemas antioxidantes/reparadores (Nrf2) e causando efeitos neuroprotetores significativos contra a doença de Alzheimer, doença de Parkinson e distúrbios relacionados com hipóxia/reperfusão(18).
Relatar as intervenções multimodais ou a vasta gama de agentes naturais ou sintéticos que atualmente estão em estudos para a modulação da sinalização redox não é o escopo desta revisão. Aqui vamos revisar como as preparações homeopáticas, já submetidas a vários estudos pré-clínicos, auxiliam na modulação dos níveis de ROS e no sistema imunológico e analisar como essas preparações ultradiluídas, não tóxicas e de baixo custo, poderiam auxiliar na prevenção ou nos tratamentos complementares/integrativos de doenças relacionadas ao envelhecimento.
Homeopatia na modulação de ROS e do sistema imunológico: possíveis utilizações terapêuticas
A homeopatia é uma especialidade médica baseada em evidências e, embora seja aplicada na prática clínica há mais de dois séculos, sua eficácia ainda é assunto de debate(19). Até o momento, não há explicações científicas concebíveis para apoiar os mecanismos de ação dos medicamentos homeopáticos. Além disso, a falta de ensaios clínicos rigorosos é um obstáculo para sustentar a credibilidade da homeopatia no meio científico(20). Contudo, vários estudos estão sendo realizados em modelos experimentais bem estabelecidos, tanto em culturas de células quanto em animais, que atestam a eficácia de preparações homeopáticas em diversas doenças(21, 22, 24, 25, 27).
Estudos in vivo, demonstraram que a redução da hipertensão e do estresse oxidativo, no coração de ratos hipertensos, por preparações homeopáticas altamente diluídas de Rauwolfia serpentina, ocorre por meio da modulação do sistema de defesa antioxidante, devido à alteração da expressão de enzimas antioxidantes. Esses resultados fornecem uma base farmacológica importante para o uso terapêutico de medicamentos preparados homeopaticamente a partir de Rauwolfia serpentina em casos de hipertensão e estresse oxidativo associado(22) .
Muitos estudos, in vitro e in vivo, com preparações complexas de várias tinturas altamente diluídas e dinamizadas, apresentaram resultados importantes na modulação da produção de ROS e da imunidade inata e no controle de progressão tumoral(24, 25, 27). Essas preparações são denominadas de “imunomoduladores homeopáticos” e são usadas na clínica médica como adjuvantes nos tratamentos de câncer. Considerando que alterações nos níveis de sinalização redox e da imunidade inata são mecanismos determinantes na fisiologia do câncer e de outras doenças relacionadas com o envelhecimento(6, 14), um olhar mais abrangente sobre a modulação biológica através desses medicamentos homeopáticos poderia colaborar para fundamentar sua utilização como agentes preventivos ou adjuvantes terapêuticos, em outras patologias que compartilham da mesma base fisiopatológica relacionada ao envelhecimento.
Por exemplo: pacientes com Covid-19 grave geralmente têm mais de 60 anos, possuem comorbidades subjacentes e apresentam uma resposta enfraquecida do sistema imunológico inato, permitindo uma rápida replicação viral, que resulta em hiperativação de células Th1 (fenótipo de células T CD4+), as quais, por sua vez, ativam macrófagos pela liberação de IFN-γ. Essa ativação leva à produção e secreção de citocinas como o TGF-β, o qual ativa as células Th17 para secretar IL17, que coletivamente produz a tempestade de citocinas. Essa tempestade de citocinas está associada ao aumento da produção de estresse oxidativo, que também induz a ativação de NF-κB em linfócitos T e macrófagos, o que promove a secreção de citocinas pró-inflamatórias (TNFα e IL 6) que também podem influenciar a resposta imunológica. A tempestade de citocinas associada ao estresse oxidativo contribui para os piores resultados durante as infecções por SARS-CoV-2. Além disso, pacientes com comorbidades apresentam ainda níveis elevados de espécies reativas de oxigênio (ROS) e estresse oxidativo causado por um aumento do acúmulo de angiotensina II e pela ativação da via da NADPH oxidase(23) .
Entre os imunomoduladores homeopáticos estudados, um denominado como “M1” nos estudos pré-clínicos, demonstrou ação moduladora da imunidade inata, diminuiu a progressão tumoral(24, 25), reduziu os níveis de ROS(26, 27) e evitou a evolução e progressão da infecção por Leishmania amazonenses(26), através da modulação dos níveis de citocinas e do retardo da resposta Th1, ou seja, modulando mecanismos que são compartilhados na indução da tempestade de citocinas da Covid-19, os quais serão melhor explicados a seguir.
Ações do imunomodulador M1
Monócitos/macrófagos representam um importante grupo de células imunes que desempenham um papel central na reação inflamatória ao desafio imunológico que produz citocinas pró-inflamatórias, quimiocinas e espécies reativas de oxigênio (explosão respiratória), realização de fagocitose e apresentação de antígeno. Macrófagos ativados são uma fonte significativa de ROS e NO (óxido nítrico), gerados por meio da chamada explosão respiratória, constitutivamente liberando citocinas pró-inflamatórias, especialmente fator de TNF-α, que ativa fatores de transcrição como o NFkB, provocando a superprodução de ROS e NO. A ativação de fatores de transcrição nos macrófagos residentes e/ou macrófagos derivados de monócitos desencadeia modificações epigenéticas que levam à patogênese de doenças crônicas(16). Os macrófagos estão no estágio central do conceito de inflammaging, pois eles são os mestres da resposta ao estresse(11).
Em estudos realizados in vitro com monócitos humanos diferenciados em macrófagos e desafiados com lipopolissacarídeo de parede bacteriana (LPS), a presença de M1 aumentou o nível de NO, mas diminuiu os níveis de H2O2 e O2-, bem como de TNF-α. Na presença de LPS, os macrófagos aumentam a produção de ROS e TNF-α, contudo na cultura de macrófagos tratados com M1 a presença de LPS não foi capaz de estimular a produção desses parâmetros na mesma proporção. O M1 demonstrou também a capacidade de diminuir a atividade do NF-κB, na linhagem celular repórter HT29-pNF-B-hrGF estimulada com TNF-α. Esses resultados indicam o efeito modulador da sinalização redox por esse medicamento homeopático, que pode aumentar a ativação de macrófagos e, ao mesmo tempo, através de uma ação inibidora do NF-κB, diminuir a expressão de citocinas pró-inflamatórias(27). O que sugere uma condição de controle do processo inflamatório e uma diminuição da exacerbação de danos por estresse oxidativo.
Em experimentos in vitro, o M1 aumentou o nível de IFNγ em macrófagos infectados por Leishmania amazonensis, após 18 horas de incubação(26), mas diminuiu os níveis de IFNγ em macrófagos desafiados por LPS, após 48 horas de incubação(27). Considerando as diferenças experimentais entre as duas situações, podemos inferir que a interferência do M1 nos níveis de IFNγ depende do tipo de desafio e do tempo. Mas essa ação moduladora representa um evento muito importante, pois o IFNγ pode aumentar a resposta imunológica inata, mas também pode exacerbar os processos inflamatórios.
O M1 foi capaz de diminuir a lesão nas patas de camundongos infectados por Leishmania amazonensis, induzindo uma resposta Th1 tardia e ao mesmo tempo aumentando o nível de IL10, que é uma citocina que antagoniza os mediadores pró-inflamatórios. Assim, na presença de M1 houve uma indução à destruição do parasita sem produzir lesão na pele dos camundongos, pois o medicamento M1 evitou a evolução e progressão da leishmaniose pelo aumento da resposta Th1 em conjunto com o aumento da IL 10, o que equilibrou os eventos inflamatórios locais e evitou a exacerbação do processo inflamatório e dano tecidual(26) .
Em um modelo de melanoma em camundongos, o tratamento com M1 levou a uma carga tumoral significativamente menor nos pulmões e tecido subcutâneo do que aquela do grupo de controle. Além disso, a progressão tumoral e a angiogênese foram diminuídas devido à inibição das células mieloides supressoras (MDSC) positivas para o receptor de angiotensina II tipo 1 (AT1R) no microambiente tumoral(25).
Em conjunto esses resultados sugerem uma ação moduladora sobre a inflammaging pela preparação homeopática. O M1 modula a atividade de macrófagos e linfócitos T (resposta Th1), altera a sinalização de ROS e diminui a ativação do fator nuclear kappa B (NF-κB), diminuindo a expressão de citocinas pró-inflamatórias, como o TNF-α, mas aumentando o nível da citocina IL10 que antagoniza os mediadores pró-inflamatórios.
Assim, o M1 poderia auxiliar na prevenção e/ou tratamento integrativo de outras patologias relacionadas com envelhecimento em que a diminuição dos níveis de ROS e uma modulação da imunidade inata participem dos mecanismos de controle do início e progressão da doença, como por exemplo câncer e agravamentos da Covid-19.
Conclusão
A modulação endógena dos mecanismos de defesa redox e do sistema imunológico inato representa uma abordagem inovadora para intervenção terapêutica em doenças associadas ao envelhecimento ou para a prevenção dessas doenças.
As preparações homeopáticas ultradiluídas de Rauwolfia serpentina e do imunomodulador homeopático M1 apresentam ações biológicas, bem definidas e demonstradas em ensaios pré-clínicos, sobre os níveis de ROS/estresse oxidativo, determinando o controle de hipertensão e da modulação redox e imunológica do microambiente tumoral, respectivamente.
Apesar do mecanismo de ação desses medicamentos homeopáticos não estar totalmente esclarecido, pois a característica da ultradiluição homeopática não permite uma análise dose-resposta convencional, essa característica também determina a ausência de toxicidade dessas preparações.
Portanto, a segurança biológica somada à eficácia terapêutica baseada em evidências e em estudos pré-clínicos permite que essas preparações homeopáticas possam ser integradas aos métodos terapêuticos convencionais de várias doenças relacionadas ao estresse oxidativo, conforme critério médico, mesmo sem a realização de estudos clínicos. Contudo, estes seriam extremamente desejáveis para fundamentar cientificamente a homeopatia.
As preparações homeopáticas, aqui apresentadas, podem ser extremamente úteis, juntamente com outras intervenções multimodais, que envolvem uma abordagem holística, como a nutrição, os exercícios físicos e o gerenciamento de estresse psicológico, para otimizar o processo de envelhecimento em direção a uma longevidade saudável, pois modulam os níveis de ROS e a imunidade inata.
Eneida Janiscki Da Lozzo – Farmacêutica, doutora em Bioquímica, pela UFPR – Universidade Federal do Paraná e diretora da Homeoterápica Farmácia de Manipulação.
Fontes
- Sies H, Jones D P. Reactive oxygen species (ROS) as pleiotropic physiological signalling agents. Nat Rev Mol Cell Biol. 2020 Jul;21(7):363-383. doi: 10.1038/s41580-020-0230- 3.
- Garrido A, Cruces J, Ceprián N, Vara E, de la Fuente M. Oxidative-inflammatory stress in immune cells from adult mice with premature aging. Int J Mol Sci. 2019 Feb 12;20(3):769 doi.org/10.3390/ijms20030769.
- Ionescu-Tucker A, Cotman C W. Emerging roles of oxidative stress in brain aging and Alzheimer’s disease. Neurobiol Aging. 2021 Nov;107:86-95. doi: 10.1016/j.neurobiolaging.2021.07.014.
- Korac B, Kalezic A, Pekovic-Vaughan V, Korac A, Jankovic A. Redox changes in obesity, metabolic syndrome, and diabetes. Redox Biol. 2021 Jun; 42:101887. doi: 10.1016/j.redox.2021.101887.
- Kang Q, Yang C. Oxidative stress and diabetic retinopathy: Molecular mechanisms, pathogenetic role and therapeutic implications. Redox Biol. 2020 Oct; 37:101799 doi.org/10.1016/j.redox.2020.101799
- Khan A Q, Rashid K, Al Amodi A A, Agha M V, Akhtar S, Hakeem I, Raza S S, Uddin S. Reactive oxygen species (ROS) in cancer pathogenesis and therapy: An update on the role of ROS in anticancer action of benzophenanthridine alkaloids. Biomedicine & Pharmacotherapy. 2021 Nov;143:112142 https://doi.org/10.1016/j.biopha.2021.112142.
- Marino A, Hausenloy D J, Andreadou I, Horman S, Bertrand L, C. AMP-activated protein kinase: A remarkable contributor to preserve a healthy heart against ROS injury. Free Rad Biol Med. 2021 Apr; 166:238-254 https://doi.org/10.1016/j.freeradbiomed.2021.02.047.
- Subramaniam D M, laxmiIyer M, Nair A P, Venkatesan D, Mathavan S, Eruppakotte N, Kizhakkillach S, Chandran M, Roy A, Abilash Valsala Gopalakrishnan A V, Vellingiri B. Oxidative stress and mitochondrial transfer: A new dimension towards ocular diseases. Gen Diseases, 2020: in press https://doi.org/10.1016/j.gendis.2020.11.020.
- Bourgonje A R, Feelisch M, Faber K N, Pasch A, Dijkstra G, van Goor H. Oxidative Stress and Redox-Modulating Therapeutics in Inflammatory Bowel Disease. Trends Mol Med. 2020 Nov;26(11):1034-1046. doi: 10.1016/j.molmed.2020.06.006.
- Ansari M Y, Ahmad N, Haqqi T M. Oxidative stress and inflammation in osteoarthritis pathogenesis: Role of polyphenols. Biomed Pharmacother. 2020 Sep; 129: 110452.https://doi.org/10.1016/j.biopha.2020.110452.
- Fulop T, Larbi A, Pawelec G, Khalil A, Cohen A A, Hirokawa K, Witkowski J M, Franceschi C. Immunology of Aging: the Birth of Inflammaging. Clin Rev Allergy Immunol. 2021 Sep 18;1-14. doi: 10.1007/s12016-021-08899-6 8.
- Franceschi C, Bonafè M, Valensin S, Olivieri F, De Luca M, Ottaviani E, De Benedictis G. Infammaging an evolutionary perspective on immunosenescence. Ann N Y Acad Sci. 2000 Jun; 908:244-54.doi: 10.1111/j.1749-6632.2000.tb06651.x.
- Franceschi C, Garagnani P, Parini P, Giuliani C, Santoro A. Infammaging: a new immune-metabolic viewpoint for age-related diseases. Nat Rev Endocrinol. 2018 Jul; 14:576–590. https:// doi.org/10.1038/s41574-018-0059-4.
- Forman H. J, Zhang H. Targeting oxidative stress in disease: promise and limitations of antioxidant therapy. Nat Rev Drug Discov. 2021 Sep; 20(9):689-709. doi: 10.1038/s41573-021-00233-1.
- Fernández-Ayala D J M, Navas P, López-Lluch G. Age-related mitochondrial dysfunction as a key factor in COVID-19 disease. Exp Gerontol. 2020 Dec; 142:111147. doi:10.1016/j.exger.2020.111147.
- Castaneda O A, Lee S-C, Ho C-T, Huang T-C. Macrophages in oxidative stress and models to evaluate the antioxidant function of dietary natural compounds. J Food Drug Anal. 2017 Jan; 25(1):111-118. doi: 10.1016/j.jfda.2016.11.006.
- Calabrese V, Cornelius C, Dinkova-Kostova A T, Iavicoli I, Di Paola R, Koverech A, Cuzzocrea S, Rizzarelli E, Calabrese E J. Cellular stress responses, hormetic phytochemicals and vitagenes in aging and longevity. Biochim Biophys Acta. 2012 May; 1822(5):753-83. doi: 10.1016/j.bbadis.2011.11.002.
- Quan H, Koltai E, Suzuki K, Aguiar Jr A S, Pinho R, Boldogh I, Berkes I, Radak Z. Exercise, redox system and neurodegenerative diseases. Biochim Biophys Acta Mol Basis Dis. 2020 Oct; 1866(10):165778. doi: 10.1016/j.bbadis.2020.165778.
- OMS, 2019. WHO Global Report on Traditional and Complementary Medicine. World Health Organization, 2019. https://apps.who.int/iris/handle/10665/312342.
- Qutubuddin, M, Singh S V, Nayak C, Koley M, Saha S. A systematic review of controlled trials of homeopathy in Bronchial asthama. Complement Med Res. 2019;26(2):111- 117. doi: 10.1159/000494621.
- Singh, S., Karwasra, R., Kalra, P., Kumar, R., Rani, S., Nayak, D., Gupta, Y.K, 2015. Role of Homoeopathic mother tinctures in rheumatoid arthritis: an experimental study. Indian J. Res. Homoeopath. 9, 42–47.
- Kumar S, Chainy G B N, Dandapat J, Hati A K, Nanda L. Comprehending the role of homeopathic preparations of Rauwolfia serpentina on oxidative stress parameters of cardiac tissue of DOCA-salt induced hypertensive male rats: An experimental approach. Phytomedicine Plus. 2021 Nov; 1(4):100115. https://doi.org/10.1016/j.phyplu.2021.100115.
- Alam M S, Czajkowsky D M. SARS-CoV-2 infection and oxidative stress: Pathophysiological insight into thrombosis and therapeutic opportunities. Cytokine & Growth Factor Reviews. Available online 15 November 2021. In Press. https://doi.org/10.1016/j.cytogfr.2021.11.001.
- Guimarães F S F, Andrade L F, Martins S T, Abud, A P R, Sene R V, Wanderer C, Tiscornia I, BollaTi-Fogolín M, Buchi D F, Trindade E S. In vitro and in vivo anticancer properties of a Calcarea carbonica derivative complex (M8) treatment in a murine melanoma model. BMC Cancer. 2010 Mar; 10:113. https://bmccancer.biomedcentral.com/articles/10.1186/1471-2407-10-113.
- Andrade L F; Mozeleski B, Leck A R, Rossi G, Costa C R V, Guimarães F S F, Zotz R, Nascimento K F, Oliveira C C, Buchi D F, Trindade E S. Inhalation therapy with M1 inhibits experimental melanoma development and metastases in mice. Homeopathy. 2016 Feb; 105(1):109-18. doi: 10.1016/j.homp.2015.08.007.
- Nascimento K F, Santana F R, Costa, C R V, Kaplum V, Volpato H, Nakamura C V, Bonamin L V, Buchi D. M1 Homeopathic Complex Trigger Effective Responses Against Leishmania (L) Amazonensis In Vivo And In Vitro. Cytokine. 2017 Nov; 99:80-90. doi: 10.1016/j.cyto.2017.07.001. 9.
- Oliveira, Carolina C, Abud A R, De Oliveira S M, Guimaraes F S F, De Andrade L F, Di Bernardi R P, Coletto E L O, Kuczera D, Da Lozzo E J; Goncalves J P, Trindade E S, Buchi D F. Developments on drug discovery and on new therapeutics: highly diluted tinctures act as biological response modifiers. BMC Complement Altern Med. 2011 Oct; 11: 101. doi: 10.1186/1472-6882-11-101.
Figuras
Figura 1 A – Wang Y, Chen Y, Zhang X, Lu Y, Chen H. New insights in intestinal oxidative stress damage and the health intervention effects of nutrients: A review. Journal of Functional Foods. 2020 – Dec; 75:104248 – https://doi.org/10.1016/j.jff.2020.104248.
Figura 1 B – Fleming E, Luo Y. Co-delivery of synergistic antioxidants from food sources for the prevention of oxidative stress. Journal of Agriculture and Food Research. 2021 – Mar; 3:100107 – https://doi.org/10.1016/j.jafr.2021.100107.