A quimioterapia continua sendo uma das principais modalidades de tratamento do câncer em todo o mundo. No entanto, seu uso e eficácia também podem acarretar efeitos colaterais prejudiciais. Mais de 50% de todos os pacientes com câncer sentem dor(1). Mas, embora as estratégias de tratamento sejam numerosas, muitas são ineficazes(2). Entre 19% e 39% dos pacientes com dor de origem oncológica experimentam alguma forma de dor neuropática, sendo que a maior proporção deles sentem dor neuropática como resultado de seu tratamento de câncer(3).
Isso é importante porque não há uma opção eficaz de prevenção ou tratamento contra neuropatia periférica induzida por quimioterapia (CIPN – Chemotherapy Induced Peripheral Neuropathy)(4), que geralmente interfere nas dosagens ou omissão de drogas antineoplásicas(5). A CIPN é experimentada por 30% a 40% dos pacientes tratados com quimioterapia neurotóxica(4-6), resultando em diminuição da qualidade de vida(7-10) e aumento dos gastos com saúde(11) e continuando por anos após a interrupção no uso dos medicamentos antineoplásicos(12-14).
Estudos recentes da Associação Internacional para o Estudo da Dor (IASP) e de um grupo de interesse especial associado à dor neuropática (NeuPSIG) mostram que a pesquisa sobre esse tipo de dor sofre de problemas metodológicos, como “critérios diagnósticos heterogêneos e perfil fenotípico pobre”(15). Estudos sobre CIPN apresentam um conjunto diversificado de critérios de diagnóstico(4,16) e falta de um “padrão-ouro” de avaliação da doença, que dificultam a metanálise de pesquisas e o desenvolvimento de opções de tratamento baseadas em evidências(17).
A complexidade da CIPN é exemplificada pela maneira como o dano neurotóxico é exercido em múltiplos locais no eixo neuronal, através de diversificados mecanismos moleculares e celulares(18). No entanto, alguns subtipos de CIPN apresentam características similares. As expressões clínicas da neuropatia induzida por oxaliplatina e paclitaxel exibem neurotoxicidade aguda com um pico no dia 3-4 e comprometimento sensorial pior do que a dor, sendo que os sintomas graves durante o primeiro ciclo preveem neurotoxicidade crônica a longo prazo aos 12 meses(19).
No nível celular, ambas as drogas produzem uma resposta pró-inflamatória com a migração de macrófagos e microglia no gânglio da raiz dorsal (DRG) e na medula espinhal, contribuindo para a sensibilização de neurônios sensoriais(18,20,21). Tais semelhanças sugerem que mecanismos fisiopatológicos sobrepõem-se e abrem a possibilidade de se estudar conjuntamente a neuropatia induzida por oxaliplatina e paclitaxel(22).
Tecnologias de multifrequências no diagnóstico de CIPN
Na clínica, o diagnóstico de CIPN geralmente é baseado em uma classificação dos sintomas (sistema de classificação CT-CAE ou avaliação neurológica) ou em um questionário para o paciente (FACT/GOG-NTX ou EORTC-CIPN20)(4,9). Esses métodos podem detectar CIPN com viés substancial (ou seja, interobservador e recall do viés do paciente)(23–25). E estudos objetivos de condução nervosa não são facilmente aplicáveis à prática clínica(26,27). Para resolver isso, o teste sensorial quantitativo (QST) pode ser usado para avaliar a CIPN(27–29).
O limiar de percepção de vibração (VPT) é uma metodologia-padrão sensorial que tem sido usada para detectar comprometimento significativo do senso de vibração em pacientes que estejam recebendo oxaliplatina e paclitaxel(30–32). No passado, os VPTs eram medidos usando-se um único diapasão de frequência(32–34) ou um bioestesiômetro(30,31,35) no espectro de 100-128 Hz. Isso permite uma variável ainda sensível detecção de CIPN manifesta, que está significativamente associada aos resultados relatados pelo paciente(30).
Após esses resultados, os pesquisadores desenvolveram uma metodologia-padrão denominada tactilometria. Enquanto os métodos-padrão VPT usam frequências únicas em locais não-táteis(36), a tactilometria de múltiplas frequências mede 7 frequências no espectro de 8-500 Hz em locais táteis(37). Recentemente, pesquisadores demonstraram a capacidade desses métodos de detectar precocemente sinais subclínicos de neuropatia diabética com alta sensibilidade(38) e uma forte correlação com medições de estudos de condução nervosa (que são o padrão-ouro de detecção de neuropatia)(39).
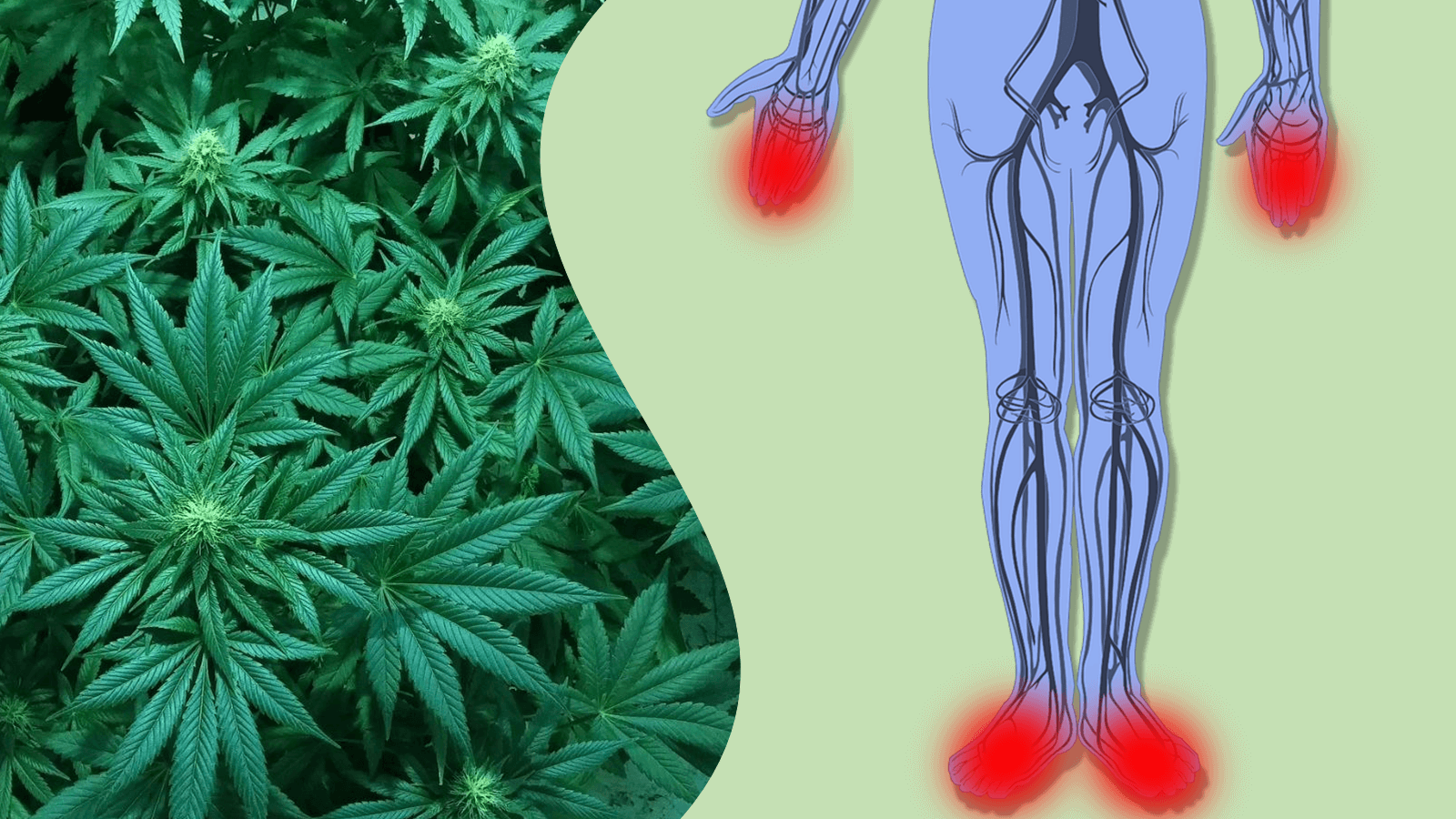
Um exame mais detalhado da fisiopatologia da CIPN revela que a toxicidade é distribuída de maneira dependente do comprimento(18,24). Como tal, pode-se inferir que medir as superfícies táteis distais dos dedos das mãos e dedos dos pés devem fornecer a detecção mais precoce de CIPN(40,41). Medir em baixas frequências (30-50 Hz) também é interessante, pois ativará os corpúsculos de Meissner, cuja diminuição de densidade foi relatada em pacientes expostos à quimioterapia com paclitaxel(23). Medindo um espectro mais amplo da percepção vibracional humana também se deve detectar CIPN com mais detalhes. Os corpúsculos de Meissner respondem por 40% da produção aferente da pele glabra e os corpúsculos de Pacini (ativados a 100-300 Hz) inervam cerca de 15% das fibras nervosas aferentes(42,43).
Além disso, a fibra nervosa terminal do corpúsculo de Meissner perde sua bainha de mielina quando entra na estrutura do corpúsculo na derme. Isso pode constituir um ponto “fraco” na estrutura da derme sensorial, resultando em danos precoces às fibras nervosas quando expostas à oxaliplatina e paclitaxel(22,44).
Com base nesses achados, é imprescindível que novos diagnósticos com a utilização da tecnologia de multifrequências sejam investigados no campo da oncologia clínica. Com o crescente número de sobreviventes de câncer e uso de quimioterapia combinada, a CIPN continuará sendo um fardo para pacientes com câncer(5,6).
Uso da farmacologia canabinoide
Os recentes avanços na farmacologia canabinoide e na pesquisa pré-clínica da neuropatia periférica induzida por quimioterapia impulsionaram os canabinoides para a vanguarda do interesse dos estudos sobre gerenciamento de CIPN(45,46).
Pesquisas relacionadas ao termo endocanabinoide, recém-cunhado e publicado na Nature Reviews em janeiro de 2020, já produziram novos tratamentos para epilepsia infantil e esclerose múltipla(47). Essas descobertas baseiam-se em pesquisas estabelecidas que mostram que os canabinoides têm propriedades neuroprotetoras e neuroanti-inflamatórias(48–50). Dados emergentes mostram que a neuroinflamação é um fator componente central na fisiopatologia da CIPN(18,21,51–53).
Estudos pré-clínicos demonstraram que o paclitaxel e a oxaliplatina podem causar insulto às células de suporte neuronal, como astrócitos, glial e células de Schwann, que resultam em inflamação neuronal(20,54-56) e dor neuropática(57). Como uma nova classe de drogas, os canabinoides são moduladores conhecidos da neuroinflamação, através de efeitos sobre o suporte das células neuronais(50,58-60). Em modelos animais de dor e neuropatia induzida por paclitaxel, os canabinoides têm demonstrado impedir o desenvolvimento de neuropatia(61–63) sem comprometer a eficácia da quimioterapia(64).
Estudos iniciais em pacientes mostraram que o tetra-hidrocanabinol (THC) tem algum efeito sobre sintomas como dor(65) e náusea(66), mas também que o lado psicotrópico causa graves efeitos, como disforia e comprometimento cognitivo(66-68). No entanto, a metodologia e insights farmacológicos usados nesses estudos já publicados não estão de acordo com os conhecimentos e padrões. Estudos clínicos e pré-clínicos recentes demonstram que os canabinoides podem prevenir(62,63,69) e tratar(46,70–72) sintomas da CIPN sem ou com apenas leves efeitos colaterais(73).
Com a compreensão e consequente diminuição do receio dos efeitos colaterais dos canabinoides, surge uma chamada para a realização de mais estudos clínicos, com o objetivo de verificar ou rejeitar as descobertas feitas com modelos animais(70,74).
Dr. Wellington Briques – Médico e Associate Director of Global Medical Affairs da Canopy Growth Corporation.
Referências
- van den Beuken-van Everdingen MHJ, de Rijke JM, Kessels AG, Schouten HC, van Kleef M, Patijn J. Prevalence of pain in patients with cancer: a systematic review of the past 40 years. Ann Oncol Off J Eur Soc Med Oncol 2007;18:1437–49. doi:10.1093/annonc/mdm056.
- Fallon M, Giusti R, Aielli F, Hoskin P, Rolke R, Sharma M, et al. Management of cancer pain in adult patients: ESMO Clinical Practice Guidelines†. Ann Oncol 2018;29:iv166–91. doi:10.1093/annonc/mdy152.
- Bennett MI, Rayment C, Hjermstad M, Aass N, Caraceni A, Kaasa S. Prevalence and aetiology of neuropathic pain in cancer patients: a systematic review. Pain 2012;153:359–65. doi:10.1016/j.pain.2011.10.028.
- Seretny M, Currie GL, Sena ES, Ramnarine S, Grant R, MacLeod MR, et al. Incidence, prevalence, and predictors of chemotherapy-induced peripheral neuropathy: A systematic review and meta-analysis. Pain 2014;155:2461–70. doi:10.1016/j.pain.2014.09.020.
- Staff NP, Grisold A, Grisold W, Windebank AJ. Chemotherapy-induced peripheral neuropathy: A current review. Ann Neurol 2017;81:772–81. doi:10.1002/ana.24951.
- Teoh D, Smith TJ, Song M, Spirtos NM. Care After Chemotherapy: Peripheral Neuropathy, Cannabis for Symptom Control, and Mindfulness. Am Soc Clin Oncol Educ Book Am Soc Clin Oncol Annu Meet 2018:469–79. doi:10.1200/EDBK_209437.
- Tofthagen C. Patient perceptions associated with chemotherapy-induced peripheral neuropathy. Clin J Oncol Nurs 2010;14:E22-8. doi:10.1188/10.CJON.E22-E28.
- Tofthagen C, Donovan KA, Morgan MA, Shibata D, Yeh Y. Oxaliplatin-induced peripheral neuropathy’s effects on health-related quality of life of colorectal cancer survivors. Support Care Cancer 2013;21:3307–13. doi:10.1007/s00520-013-1905-5.
- Mols F, Beijers T, Vreugdenhil G, van de Poll-Franse L. Chemotherapy-induced peripheral neuropathy and its association with quality of life: a systematic review. Support Care Cancer 2014;22:2261–9. doi:10.1007/s00520-014-2255-7.
- Ezendam NPM, Pijlman B, Bhugwandass C, Pruijt JFM, Mols F, Vos MC, et al. Chemotherapyinduced peripheral neuropathy and its impact on health-related quality of life among ovarian cancer survivors: results from the population-based PROFILES registry. Gynecol Oncol 2018;135:510–7. doi:10.1124/jpet.117.245704.
- Pike CT, Birnbaum HG, Muehlenbein CE, Pohl GM, Natale RB. Healthcare Costs and Workloss Burden of Patients with Chemotherapy-Associated Peripheral Neuropathy in Breast, Ovarian, Head and Neck, and Nonsmall Cell Lung Cancer. Chemother Res Pract 2012;2012:1–10. doi:10.1155/2012/913848.
- Ventzel L, Jensen AB, Jensen AR, Jensen TS, Finnerup NB. Chemotherapy-induced pain and neuropathy: a prospective study in patients treated with adjuvant oxaliplatin or docetaxel. Pain 2016;157:560–8. doi:10.1097/j.pain.0000000000000404.
- Bennedsgaard KJ, Ventzel L, Jensen AB, Jensen AR, Tankisi H, Finnerup NB. Chronic neuropathic pain following oxaliplatin and docetaxel: A 5-year follow-up questionnaire study. Scand J Pain 2017;16:166–166. doi:10.1016/j.sjpain.2017.04.009.
- Eckhoff L, Knoop A, Jensen MB, Ewertz M. Persistence of docetaxel-induced neuropathy and impact on quality of life among breast cancer survivors. Eur J Cancer 2015;51:292–300. doi:10.1016/j.ejca.2014.11.024.
- Finnerup NB, Attal N, Haroutounian S, McNicol E, Baron R, Dworkin RH, et al. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis. Lancet Neurol 2015;14:162–73. doi:10.1016/S1474-4422(14)70251-0.
- Ilhan E, Chee E, Hush J, Moloney N. The prevalence of neuropathic pain is high after treatment for breast cancer: a systematic review. Pain 2017;158:2082–91. doi:10.1097/j.pain.0000000000001004.
- Farquhar-Smith P. Chemotherapy-induced neuropathic pain. Curr Opin Support Palliat Care 2011;5:1–7. doi:10.1097/SPC.0b013e328342f9cc.
- Starobova H, Vetter I. Pathophysiology of Chemotherapy-Induced Peripheral Neuropathy. Front Mol Neurosci 2017;10:174. doi:10.3389/fnmol.2017.00174.
- Pachman DR, Qin R, Seisler D, Smith EML, Kaggal S, Novotny P, et al. Comparison of oxaliplatin and paclitaxel-induced neuropathy (Alliance A151505). Support Care Cancer 2016;24:5059–68. doi:10.1007/s00520-016-3373-1.
- Peters CM, Jimenez-Andrade JM, Kuskowski MA, Ghilardi JR, Mantyh PW. An evolving cellular pathology occurs in dorsal root ganglia, peripheral nerve and spinal cord following intravenous administration of paclitaxel in the rat. Brain Res 2007;1168:46–59. doi:10.1016/j.brainres.2007.06.066.
- Makker PGS, Duffy SS, Lees JG, Perera CJ, Tonkin RS, Butovsky O, et al. Characterisation of Immune and Neuroinflammatory Changes Associated with Chemotherapy-Induced Peripheral Neuropathy. PLoS One 2017;12:e0170814. doi:10.1371/journal.pone.0170814.
- Xiao WH, Zheng H, Bennett GJ. Characterization of oxaliplatin-induced chronic painful peripheral neuropathy in the rat and comparison with the neuropathy induced by paclitaxel. Neuroscience 2012;203:194–206. doi:10.1016/j.neuroscience.2011.12.023.
- Velasco R, Bruna J. Taxane-Induced Peripheral Neurotoxicity. Toxics 2015;3:152–69. doi:10.3390/toxics3020152.
- Park SB, Goldstein D, Krishnan A V., Lin CS-Y, Friedlander ML, Cassidy J, et al. Chemotherapy-induced peripheral neurotoxicity: A critical analysis. CA Cancer J Clin 2013;63:419–37. doi:10.3322/caac.21204.
- Choi BCK, Pak AWP. A catalog of biases in questionnaires. Prev Chronic Dis 2004;2:A13–A13.
- Chong PST, Cros DP. Technology literature review: quantitative sensory testing. Muscle Nerve 2004;29:734–47. doi:10.1002/mus.20053.
- McCrary JM, Goldstein D, Boyle F, Cox K, Grimison P, Kiernan MC, et al. Optimal clinical assessment strategies for chemotherapy-induced peripheral neuropathy (CIPN): a systematic review and Delphi survey. Support Care Cancer 2017;25:3485–93. doi:10.1007/s00520-017-3772-y.
- Hausheer FH, Schilsky RL, Bain S, Berghorn EJ, Lieberman F. Diagnosis, Management, and Evaluation of Chemotherapy-Induced Peripheral Neuropathy. Semin Oncol 2006;33:15–49. doi:10.1053/j.seminoncol.2005.12.010.
- Krøigård T, Schrøder HD, Qvortrup C, Eckhoff L, Pfeiffer P, Gaist D, et al. Characterization and diagnostic evaluation of chronic polyneuropathies induced by oxaliplatin and docetaxel comparing skin biopsy to quantitative sensory testing and nerve conduction studies. Eur J Neurol 2014;21:623–9. doi:10.1111/ene.12353.
- Curry ZA, Wilkerson JL, Bagdas D, Kyte SL, Patel N, Donvito G, et al. Association between patient reported outcomes and quantitative sensory tests for measuring long-term neurotoxicity in breast cancer survivors treated with adjuvant paclitaxel chemotherapy. Breast Cancer Res Treat 2018;125:767–74. doi:10.1124/jpet.117.245704.
- Forsyth PA, Balmaceda C, Peterson K, Seidman AD, Brasher P, DeAngelis LM. Prospective study of paclitaxel-induced peripheral neuropathy with quantitative sensory testing. J Neurooncol 1997;35:47–53. doi:10.1023/A:1005805907311.
- Attal N, Bouhassira D, Gautron M, Vaillant JN, Mitry E, Lepère C, et al. Thermal hyperalgesia as a marker of oxaliplatin neurotoxicity: a prospective quantified sensory assessment study. Pain 2009;144:245–52. doi:10.1016/j.pain.2009.03.024.
- Berger T, Malayeri R, Doppelbauer A, Krajnik G, Huber H, Auff E, et al. Neurological monitoring of neurotoxicity induced by paclitaxel/cisplatin chemotherapy. Eur J Cancer 1997;33:1393–9. doi:10.1016/S0959-8049(97)00103-2.
- Griffith KA, Couture DJ, Zhu S, Pandya N, Johantgen ME, Cavaletti G, et al. Evaluation of chemotherapy-induced peripheral neuropathy using current perception threshold and clinical evaluations. Support Care Cancer 2014;22:1161–9. doi:10.1007/s00520-013-2068-0.
- du Bois A, Schlaich M, Lück HJ, Mollenkopf A, Wechsel U, Rauchholz M, et al. Evaluation of neurotoxicity induced by paclitaxel second-line chemotherapy. Support Care Cancer 1999;7:354–61. doi:10.1007/s005200050275.
- Goldberg JM, Lindblom U. Standardised method of determining vibratory perception thresholds for diagnosis and screening in neurological investigation. J Neurol Neurosurg Psychiatry 1979;42:793–803. doi:10.1136/jnnp.42.9.793.
- Dahlin LB, Güner N, Elding Larsson H, Speidel T. Vibrotactile perception in finger pulps and in the sole of the foot in healthy subjects among children or adolescents. PLoS One 2015;10:e0119753–e0119753. doi:10.1371/journal.pone.0119753.
- Ising E, Dahlin LB, Elding Larsson H. Impaired vibrotactile sense in children and adolescents with type 1 diabetes – Signs of peripheral neuropathy. PLoS One 2018;13:e0196243. doi:10.1371/journal.pone.0196243.
- Eero L, Ekman L, Apelqvist J. Comparison between multifrequency vibrometry, neurothesiometer and nerve conduction studies in subjects with type 1 diabetes. Conf. Eur. Assoc. Study Diabetes, Barcelona: European Association for the Study of Diabetes; 2019.
- Fukuda Y, Li Y, Segal RA. A Mechanistic Understanding of Axon Degeneration in Chemotherapy-Induced Peripheral Neuropathy. Front Neurosci 2017;11:481. doi:10.3389/fnins.2017.00481.
- Burakgazi AZ, Messersmith W, Vaidya D, Hauer P, Hoke A, Polydefkis M. Longitudinal assessment of oxaliplatin-induced neuropathy. Neurology 2011;77:980–6. doi:10.1212/WNL.0b013e31822cfc59.
- Paré M, Elde R, Mazurkiewicz JE, Smith a M, Rice FL. The Meissner corpuscle revised: a multiafferented mechanoreceptor with nociceptor immunochemical properties. J Neurosci 2001;21:7236–46.
- Pietra BA, Kantor PF, Bartlett HL, Chin C, Canter CE, Larsen RL, et al. Neuroscience, Mechanoreceptors Specialized to Receive Tactile Information. Circulation 2012;126:1079– 86. doi:10.1161/CIRCULATIONAHA.110.011999.
- Bennett GJ, Liu GK, Xiao WH, Jin HW, Siau C. Terminal arbor degeneration–a novel lesion produced by the antineoplastic agent paclitaxel. Eur J Neurosci 2011;33:1667–76. doi:10.1111/j.1460-9568.2011.07652.x.
- Blanton HL, Brelsfoard J, DeTurk N, Pruitt K, Narasimhan M, Morgan DJ, et al. Cannabinoids: Current and Future Options to Treat Chronic and Chemotherapy-Induced Neuropathic Pain. Drugs 2019;79:969–95. doi:10.1007/s40265-019-01132-x.
- O’Hearn S, Diaz P, Wan BA, DeAngelis C, Lao N, Malek L, et al. Modulating the endocannabinoid pathway as treatment for peripheral neuropathic pain: a selected review of preclinical studies. Ann Palliat Med 2017;6:S209–14. doi:10.21037/apm.2017.08.04.
- Cristino L, Bisogno T, Di Marzo V. Cannabinoids and the expanded endocannabinoid system in neurological disorders. Nat Rev Neurol 2019. doi:10.1038/s41582-019-0284-z.
- Maccarrone M, Bab I, Bíró T, Cabral GA, Dey SK, Di Marzo V, et al. Endocannabinoid signaling at the periphery: 50 years after THC. Trends Pharmacol Sci 2015;36:277–96. doi:10.1016/j.tips.2015.02.008.
- Crippa JA, Guimarães FS, Campos AC, Zuardi AW. Translational Investigation of the Therapeutic Potential of Cannabidiol (CBD): Toward a New Age. Front Immunol 2018;9:2009. doi:10.3389/fimmu.2018.02009.
- Kozela E, Juknat A, Vogel Z. Modulation of Astrocyte Activity by Cannabidiol, a Nonpsychoactive Cannabinoid. Int J Mol Sci 2017;18:1669. doi:10.3390/ijms18081669.
- Boyette-Davis J, Xin W, Zhang H, Dougherty PM. Intraepidermal nerve fiber loss corresponds to the development of taxol-induced hyperalgesia and can be prevented by treatment with minocycline. Pain 2011;152:308–13. doi:10.1016/j.pain.2010.10.030.
- Boyette-Davis J, Dougherty PM. Protection against oxaliplatin-induced mechanical hyperalgesia and intraepidermal nerve fiber loss by minocycline. Exp Neurol 2011;229:353– 7. doi:10.1016/j.expneurol.2011.02.019.
- Apostolidis L, Schwarz D, Xia A, Weiler M, Heckel A, Godel T, et al. Dorsal root ganglia hypertrophy as in vivo correlate of oxaliplatin-induced polyneuropathy. PLoS One 2017;12:1–15. doi:10.1371/journal.pone.0183845.
- Di Cesare Mannelli L, Pacini A, Micheli L, Tani A, Zanardelli M, Ghelardini C. Glial role in oxaliplatin-induced neuropathic pain. Exp Neurol 2014;261:22–33. doi:10.1016/j.expneurol.2014.06.016.
- Paszcuk AF, Dutra RC, da Silva KABS, Quintão NLM, Campos MM, Calixto JB. Cannabinoid agonists inhibit neuropathic pain induced by brachial plexus avulsion in mice by affecting glial cells and MAP kinases. PLoS One 2011;6:e24034. doi:10.1371/journal.pone.0024034.
- Zhang H, Li Y, De Carvalho-Barbosa M, Kavelaars A, Heijnen CJ, Albrecht PJ, et al. Dorsal Root Ganglion Infiltration by Macrophages Contributes to Paclitaxel Chemotherapy-Induced Peripheral Neuropathy. J Pain 2016;17. doi:10.1016/j.jpain.2016.02.011.
- Mika J, Zychowska M, Popiolek-Barczyk K, Rojewska E, Przewlocka B. Importance of glial activation in neuropathic pain. Eur J Pharmacol 2013;716:106–19. doi:10.1016/j.ejphar.2013.01.072.
- Perez M, Benitez SU, Cartarozzi LP, Del Bel E, Guimarães FS, Oliveira ALR. Neuroprotection and reduction of glial reaction by cannabidiol treatment after sciatic nerve transection in neonatal rats. Eur J Neurosci 2013;38:3424–34. doi:10.1111/ejn.12341.
- Xu JJ, Diaz P, Bie B, Astruc-Diaz F, Wu J, Yang H, et al. Spinal gene expression profiling and pathways analysis of a CB2 agonist (MDA7)-targeted prevention of paclitaxel-induced neuropathy. Neuroscience 2014;260:185–94. doi:10.1016/j.neuroscience.2013.12.028.
- Labra VC, Santibáñez CA, Gajardo-Gómez R, Díaz EF, Gómez GI, Orellana JA. The Neuroglial Dialog Between Cannabinoids and Hemichannels. Front Mol Neurosci 2018;11:1–17. doi:10.3389/fnmol.2018.00079.
- Rahn EJ, Deng L, Thakur GA, Vemuri K, Zvonok AM, Lai YY, et al. Prophylactic cannabinoid administration blocks the development of paclitaxel-induced neuropathic nociception during analgesic treatment and following cessation of drug delivery. Mol Pain 2014;10:27. doi:10.1186/1744-8069-10-27.
- Naguib M, Xu JJ, Diaz P, Brown DL, Cogdell D, Bie B, et al. Prevention of paclitaxel-induced neuropathy through activation of the central cannabinoid type 2 receptor system. Anesth Analg 2012;114:1104–20. doi:10.1213/ANE.0b013e31824b0191.
- King KM, Myers AM, Soroka-Monzo AJ, Tuma RF, Tallarida RJ, Walker EA, et al. Single and combined effects of Δ(9) -tetrahydrocannabinol and cannabidiol in a mouse model of chemotherapy-induced neuropathic pain. Br J Pharmacol 2017;174:2832–41. doi:10.1111/bph.13887.
- Ward SJ, Ramirez MD, Neelakantan H, Walker EA. Cannabidiol prevents the development of cold and mechanical allodynia in paclitaxel-treated female C57Bl6 mice. Anesth Analg 2011;113:947–50. doi:10.1213/ANE.0b013e3182283486.
- Blake A, Wan BA, Malek L, DeAngelis C, Diaz P, Lao N, et al. A selective review of medical cannabis in cancer pain management. Ann Palliat Med 2017;6:S215–22. doi:10.21037/apm.2017.08.05.
- Herrstedt J, Aapro MS, Smyth JF, Del Favero A. Corticosteroids, dopamine antagonists and other drugs. Support Care Cancer 1998;6:204–14. doi:10.1007/s005200050155.
- Noyes R, Brunk SF, Baram DA, Canter A. Analgesic effect of delta-9-tetrahydrocannabinol. J Clin Pharmacol 1975;15:139–43. doi:10.1002/j.1552-4604.1975.tb02348.x.
- Noyes R, Brunk SF, Avery DA, Canter AC. The analgesic properties of delta-9- tetrahydrocannabinol and codeine. Clin Pharmacol Ther 1975;18:84–9. doi:10.1002/cpt197518184.
- Ward SJ, McAllister SD, Kawamura R, Murase R, Neelakantan H, Walker EA. Cannabidiol inhibits paclitaxel-induced neuropathic pain through 5-HT(1A) receptors without diminishing nervous system function or chemotherapy efficacy. Br J Pharmacol 2014;171:636–45. doi:10.1111/bph.12439.
- Lynch ME, Cesar-Rittenberg P, Hohmann AG. A double-blind, placebo-controlled, crossover pilot trial with extension using an oral mucosal cannabinoid extract for treatment of chemotherapy-induced neuropathic pain. J Pain Symptom Manage 2014;47:166–73. doi:10.1016/j.jpainsymman.2013.02.018.
- Deng L, Guindon J, Cornett BL, Makriyannis A, Mackie K, Hohmann AG. Chronic Cannabinoid Receptor 2 Activation Reverses Paclitaxel Neuropathy Without Tolerance or Cannabinoid Receptor 1–Dependent Withdrawal. Biol Psychiatry 2015;77:475–87. doi:10.1016/j.biopsych.2014.04.009.
- Mulpuri Y, Marty VN, Munier JJ, Mackie K, Schmidt BL, Seltzman HH, et al. Synthetic peripherally-restricted cannabinoid suppresses chemotherapy-induced peripheral neuropathy pain symptoms by CB1 receptor activation. Neuropharmacology 2018;139:85– 97. doi:10.1016/j.neuropharm.2018.07.002.
- Hoggart B, Ratcliffe S, Ehler E, Simpson KH, Hovorka J, Lejčko J, et al. A multicentre, openlabel, follow-on study to assess the long-term maintenance of effect, tolerance and safety of THC/CBD oromucosal spray in the management of neuropathic pain. J Neurol 2015;262:27–40. doi:10.1007/s00415-014-7502-9.
- Casey SL, Vaughan CW. Plant-Based Cannabinoids for the Treatment of Chronic Neuropathic Pain. Med (Basel, Switzerland) 2018;5:67. doi:10.3390/medicines5030067.
- Le-Rademacher J, Kanwar R, Seisler D, Pachman DR, Qin R, Abyzov A, et al. Patient-reported (EORTC QLQ-CIPN20) versus physician-reported (CTCAE) quantification of oxaliplatin- and paclitaxel/carboplatin-induced peripheral neuropathy in NCCTG/Alliance clinical trials. Support Care Cancer 2017;25:3537–44. doi:10.1007/s00520-017-3780-y.
- Dean A, Sullivan K, Soe M. OpenEpi: Open Source Epidemiologic Statistics for Public Health 2013.
- Barri T, Holmer-Jensen J, Hermansen K, Dragsted LO. Metabolic fingerprinting of high-fat plasma samples processed by centrifugation- and filtration-based protein precipitation delineates significant differences in metabolite information coverage. Anal Chim Acta 2012. doi:10.1016/j.aca.2011.12.065.